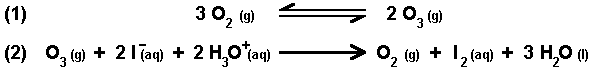> Deutsch > Climate Encyclopaedia > Klima in Städten > Mehr > 1. Luft-Verschmutzung > * Arbeitsblatt 2
|
|
 |
Klima in Städten
Mehr |
1. Luftverschmutzung - Mehr
Arbeitsblatt 2: Ozon in den Städten und stadtnahen Gebieten.
|
Informationen zu einem Versuch zur Erzeugung und quantitativen Bestimmung von Ozon:
(Wenn du den Versuch selber durchführen willst: Achtung: Von einigen Chemikalien und vom UV-Licht gehen Gefahren aus. Informiere dich bezüglich der Chemikalien. Experimentiere mit Bedacht und schütze dich!)
In einem Versuch wird eine Sauerstoff-Atmosphäre, die mit 40 ml Kaliumiodid-Lösung (w=10%), 10 ml Schwefelsäure (c=0,025 mol/L) und einigen Tropfen Stärke-Lösung unterschichtet ist, 20 min lang in einem wassergekühlten Tauchlampenreaktor (siehe Bild 1) bestrahlt. 20ml der inzwischen tiefblauen Lösung werden zuerst mit Natriumthiosulfat-Lösung (c=0,001 mol/L) bis farblos titriert und anschließend (nach Zugabe von Bromthymolblau) mit Natronlauge (c=0,005 mol/L) bis zum Blauumschlag.
In weiteren Ansätzen werden dem Sauerstoff verschiedene Gase (Dichlordifluormethan, Methan, Stickstoffdioxid) hinzugegeben. Insgesamt werden bei den Versuchen folgende Messergebnisse erhalten:
|
 |
 |
 |
|
1. Apparatur zur Erzeugung und quantitativen Bestimmung von Ozon.
© Tausch, von Wachtendonk: Chemie 2000+; Buchner Verlag, Bamberg 2001
|
|
|
Atmosphäre |
O2 |
O2 +
CCl2F2 |
O2 +
NO2 |
O2 +
NO2 +
CH4 |
O2 +
CH4 |
O2 + NO2
Dunkelversuch (ohne Bestrahlung) |
|
Bestimmung von Iod: VS(Na2S2O3) = |
46.0 mL |
104.0 mL |
94.4 mL |
78.4 mL |
72.0 mL |
112.0 mL |
|
Bestimmung der Restsäure
VS(NaOH) = |
31.4 mL |
37.1 mL |
30.6 mL |
27.2 mL |
32.3 mL |
39.5 mL |
|
A1 |
Berechne auf einem separaten Blatt aus den Versuchsergebnissen die jeweiligen Ozon-Mengen in mol und trage diese in die Tabelle unten ein. (vergleiche evtl. mit der Musterrechnung für O2-Atmosphäre.) |
|
Atmosphäre |
O2 |
O2 +
CCl2F2 |
O2 +
NO2 |
O2 +
NO2 +
CH4 |
O2 +
CH4 |
O2 + NO2
Dunkelversuch |
|
Bestimmung von Iod:
n(O3) in 10-5mol |
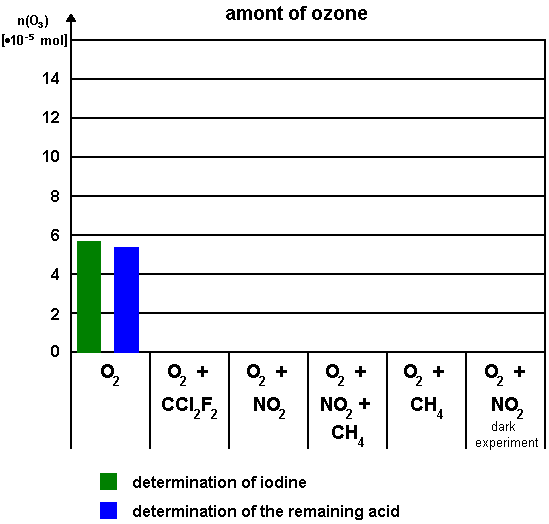
5.75 |
|
|
|
|
|
|
Bestimmung der Restsäure
n(O3) in 10-5mol |
5.40 |
|
|
|
|
|
Zwei Reaktionen im Reaktor (An der Phasengrenze läuft die Reaktion (2) ab): |
|
|
A2 |
Ozon ist relativ schlecht wasserlöslich. Begründe kurz unter Bezug zu den Reaktionsgleichungen (1) und (2), warum im Versuch stark gerührt werden muss. |
|
A3 |
Trage die in Aufgabe 1 berechneten Werte in folgendes Diagramm ein. |
|
|
|
A4 |
Was fällt dir beim Vergleich der verschiedenen Ergebnisse auf? |
|
|
A5 |
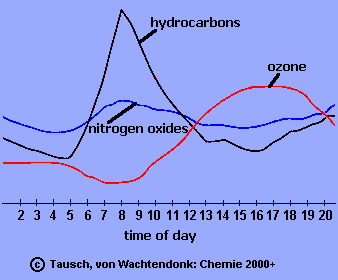
Im Bild 2 siehst du den relativen Gehalt einiger Schadstoffe in der Luft im Verlauf eines Sommertages. Erkläre, wie die Peaks in den Morgenstunden zu Stande kommen und woran man erkennt, dass die Kohlenwasserstoffe und die Stickoxide die Vorläufer des Ozons in den Städten und stadtnahen Gebieten sind. |
|
 |
 |
 |
|
2. Schadstoffgehalte der Luft an einem Sommertag.
|
|
|
|
A6 |
Der Iodnachweis für Ozon reagiert auch auf Zigarettenrauch positiv. Kann das Ozon sein? (vgl. auch Dunkelversuch bei Aufgabe 1) |
|
About this page:
Authors: M. Seesing, M. Tausch - Universität Duisburg-Essen, Duisburg / Germany
Translation: Elmar Uherek - MPI Chemistry Mainz - 2005-04-22
Last update: 2004-05-24 |
 > Deutsch > Climate Encyclopaedia > Klima in Städten > Mehr > 1. Luft-Verschmutzung > * Arbeitsblatt 2
> Deutsch > Climate Encyclopaedia > Klima in Städten > Mehr > 1. Luft-Verschmutzung > * Arbeitsblatt 2