> Polski > Climate Encyclopaedia > Stratosfera > podstawy > 2. Dziura ozonowa > - CFC i dziura ozonowa
> Polski > Climate Encyclopaedia > Stratosfera > podstawy > 2. Dziura ozonowa > - CFC i dziura ozonowa
|
StratosferaWiadomości podstawowe |
Chlorofluorowęglowodory (CFC) i dziura ozonowaHistoria powstawania dziury ozonowej jest dobrym przykładem na to jak pozornie nieszkodliwa grupa związków chemicznych może stać się prawdziwym zagrożeniem dla życia na Ziemi, a także na to jak rządy państw, przedstawiciele sektora przemysłowego i obywatele mogą współpracować aby zbadać i rozwiązać ten problem.
|
|
Każda zmiana wywołana przez człowieka w systemie klimatycznym może zakłócić naturalną równowagę ziemskiego ekosystemu w sposób trudny do przewidzenia. Jeśli jednak społeczność międzynarodowa będzie umiała odpowiednio pokierować swoimi działaniami to globalne problemy środowiskowe będzie można rozwiązać.
|
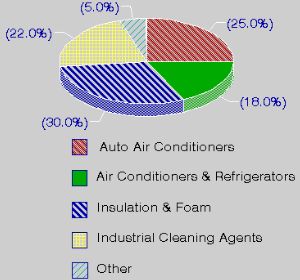
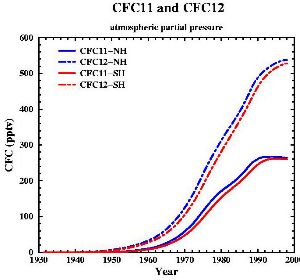
Wykorzystanie i właściwości CFCChlorofluorowęglowodory to związki takie jak np. CFCl3 lub CF2Cl2 (potocznie nazywane są freonami, choć to nazwa handlowa, nie chemiczna). CFC są używane w wielu procesach przemysłowych i w wielu produktach, jako substancja chłodząca, rozpuszczalnik w przemyśle elektronicznym, środek pieniący, rozpylający. Freony można znaleźć w gaśnicach, środkach do czyszczenia na sucho, środkach do usuwania tłuszczu, materiałach izolacyjnych (w tym budowlanych) i styropianie. |
|
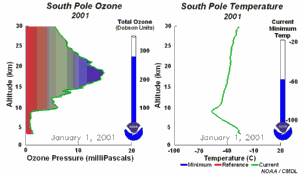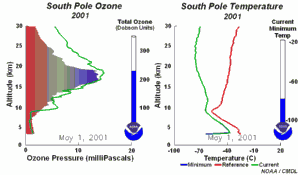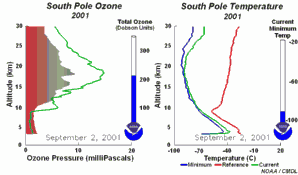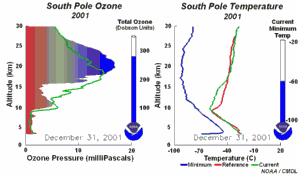
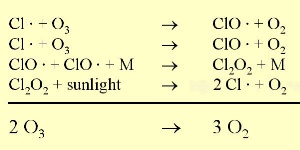
Reakcje chemiczneOzon tworzący warstwę ozonową jest w stanie równowagi; tworzy się i jest niszczony pod wpływem promieniowania UV. Rodniki chloru (Cl
|
|
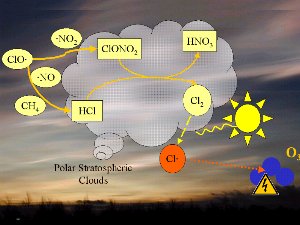
Warunki pogodoweRozpad CFC prowadzi w kolejnych reakcjach do powstania rodników ClO
|
|
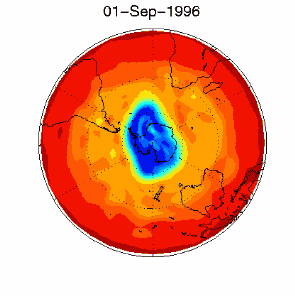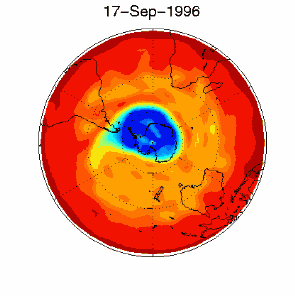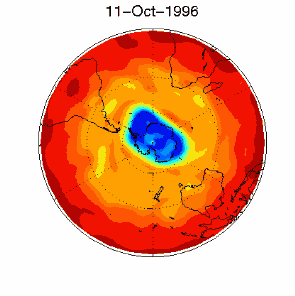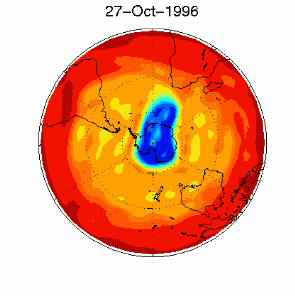
1) Jednym z czynników jest niezwykle niska temperatura panująca w stratosferze, około -80°C lub nawet mniej, nad Antarktydą, w czasie nocy polarnej. W takich warunkach kwas azotowy i woda tworzą lodowe chmury stratosferyczne, które nie są w stanie przetrwać zbyt długo przy wyższych temperaturach. Na powierzchni tych chmur lodowych HCl i ClONO2 reagują ze sobą i tworzą kwas azotowy i czysty chlor Cl2.
|
Rodnik chloru Cl |
|
|
3) Ostatecznie cały proces nie powinien przebiegać zbyt gwałtownie i nie powinien szkodzić tej części polarnej warstwy ozonowej, w której występuje najwyższe stężenie ozonu (wysokość 14-22 km), ponieważ związek źródłowy ClO Jak widzimy, warunki do tworzenia się dziury ozonowej (niskie temperatury w czasie nocy polarnej, tworzenie się chmur lodowych, wir okołobiegunowy) są tak szczególne, że proces ten prawdopodobnie nigdy nie zostałby objaśniony czy choćby przewidziany przez naukowców, gdyby nie jego rzeczywiste obserwacje. |
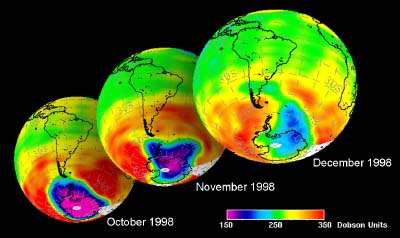
Przyszłość dziury ozonowejCFC są obecnie substancjami zabronionymi na świecie (dzięki protokołowi montrealskiemu dotyczącemu substancji niszczących ozon z 1987 wraz z późniejszymi poprawkami). Wskutek ich trwałości zajmie następne 50 lat zanim CFC dotychczas wprowadzone do atmosfery zostaną z niej usunięte a poziom zawartości ozonu stratosferycznego ustabilizuje się. Naukowcy uważają, że w roku 2000 dziura ozonowa osiągnęła swoje maksymalne rozmiary, gdyż w ciągu ostatnich kilku lat nie ulegały one znacznym zmianom. Jednakże od każdej reguły zdarzają się wyjątki. W roku 2002 wcale nie obserwowano znaczących ubytków ozonu. Powód był prosty: było zbyt ciepło i wir okołobiegunowy nie miał takiego zasięgu jak zwykle. Jeszcze raz przekonaliśmy się, że procesy atmosferyczne czasem wymykają się przewidywaniom. Natomiast w roku 2003 dziura ozonowa znowu dała o sobie znać, przyjmując poprzednie rozmiary, a nawet osiągając drugą co do wielkości notowaną wielkość. |
|
1. Recenzent: Dr Rajendra Shende, Head Energy and Ozone Action, United Nations Environment Programme 2003-10-06 2. Recenzent: Dr John Crowley - Max Planck Institute for Chemistry, Moguncja, Niemcy 2004-05-06 Konsultacja dydaktyczna: Hendrik Förster i jego uczniowie, Gimnazjum Nordpfalz Kirchheim-Bolanden - marzec 2004 r. Ostatnia aktualizacja: 2007-03-15 Tłumaczenie na język polski: Dr Anita Bokwa, Uniwersytet Jagielloński, Kraków |
Polecane strony internetowe:
|