> Português > Climate Encyclopaedia > A alta atmosfera > mais > 2. O ozono > - Química do cloro
> Português > Climate Encyclopaedia > A alta atmosfera > mais > 2. O ozono > - Química do cloro
|
A alta atmosferaSaber mais |
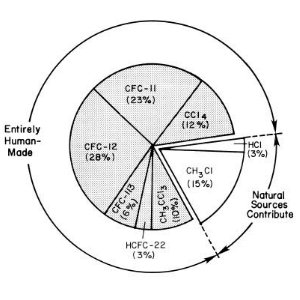
Química do cloroA química do cloro é a principal responsável pela destruição da camada do ozono. A produção industrial e a utilização dos clorofluorcarbonetos (CFC) introduziram uma nova fonte de cloro na atmosfera. Actualmente existe seis vezes mais cloro do que o produzido por fontes naturais, com consequências dramáticas na camada do ozono. Contudo ninguém previu até que ponto estes compostos eram perigosos, porque as condições necessárias para a formação do buraco do ozono são tão pouco usuais.
|
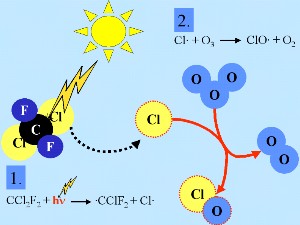
Química do cloro estratosférico – as basesGeralmente, como muitos outros radicais X X Esta reacção em cadeia conduz à depleção do ozono. |
|
O radical inicial X É necessário um composto inerte (M) como parte da reacção para utilizar a energia em excesso. |
|
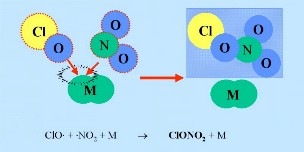
ClO HCl e ClONO2 constituem o denominado “reservatório de espécies”, pois aqui o cloro não é activo. Estas espécies não reagem com o ozono. Normalmente permanecem na fase gasosa e são removidas lentamente da estratosfera. Assim, na química estratosférica na fase gasosa normal, só se espera que ocorra uma ligeira depleção do ozono. Contudo estas espécies são transportadas para a baixa estratosfera pela circulação média, na região polar de inverno... |
|
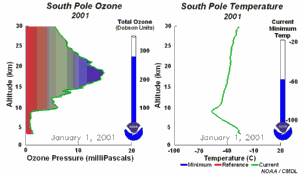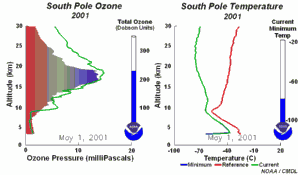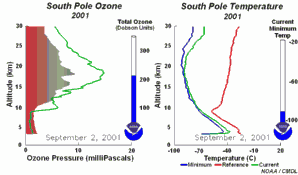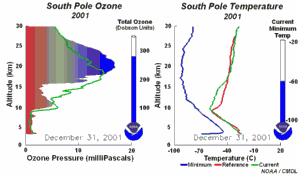
As condições peculiares do buraco do ozono antárcticoDurante a noite polar as temperaturas do ar podem descer até -80ºC. Sob estas condições, as pequenas quantidades de água e de ácido nítrico presentes na estratosfera gelam, formando as nuvens estratosféricas polares. Podem então ocorrer as cinco condições chave:
|
|
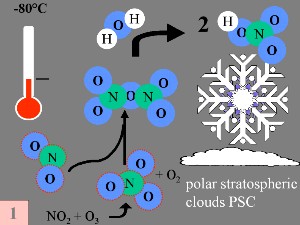
Primeira: O óxido de nitrogénio (NO) e o dióxido de nitrogénio (NO2) (que ajudam a converter ClO
O produto final é o ácido nítrico (HNO3) que é incorporado nas partículas das nuvens estratosféricas polares. |
|
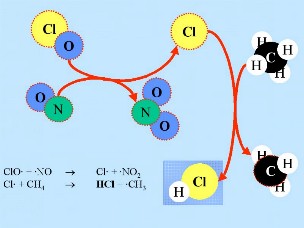
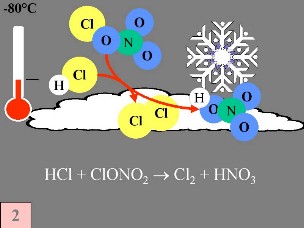
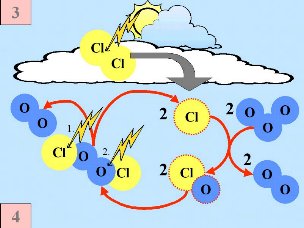
Segunda: O HCl e o ClONO2 reagem um com o outro à superfície das nuvens estratosféricas polares produzindo Cl2 e HNO3. Este ácido nítrico é imediatamente incorporado nas partículas de gelo das nuvens. Terceira: Quando o Sol nasce, no final do Inverno polar, o Cl2 é degradado pela radiação solar, produzindo-se dois radicais Cl
|
|
Quarta: Se não houver disponíveis óxidos de nitrogénio para os remover, os radicais cloro iniciam uma cadeia catalítica de reacções que conduz à destruição do ozono. Note que a velocidade de destruição do ozono é quadrática da concentração do cloro (ou ClO). Cl efectivo: 2 O3 -> 3 O2 |
|
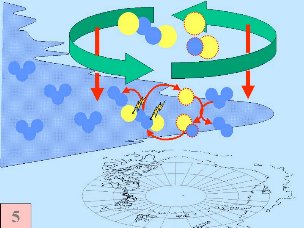
Quinta: Normalmente formam-se espécies de cloro tais como Cl Eis como as espécies cloro destruidoras do ozono são transportadas para altitudes inferiores, para a região onde está acumulada a maior parte do ozono. |
Juntam-se as cinco condições que permitem a formação do buraco do ozono. Por este motivo a maior depleção do ozono ocorre apenas na região polar (principalmente na região antárctica) e apenas na Primavera, assim que o Sol nasce após o Inverno polar (Setembro/Outubro). Mais tarde, ao longo do ano, as temperaturas do ar sobem, as nuvens polares derretem, os óxidos de nitrogénio tornam-se disponíveis novamente, o vórtice polar desaparece, impedindo o transporte para a baixa estratosfera de espécies reactivas de cloro, e a camada do ozono recupera. Por vezes ocorrem condições comparáveis sobre o ártico, em Março, formando-se também um pequeno buraco do ozono sobre o norte da Europa. |
|
M*: Em qualquer reacção do tipo A + B -> C é necessário um outro elemento, que absorva a energia em excesso. De outro modo o produto C teria a mesma energia que a energia armazenada na soma dos reagentes A + B e ocorreria a reacção na direcção oposta. Na maioria destes casos M é o nitrogénio (N2), do ar.
|
Revisão científica: Dr. Christoph Brühl - MPI for Chemistry, Mainz Revisão educacional: Michael Seesing - Uni Duisburg - 2003-08-07 Versão portuguesa: Margarida L. R. Liberato - Dep. de Física, UTAD, Portugal |