> Deutsch > Climate Encyclopaedia > Obere Atmosphäre > Mehr > 2. Ozon > - Stratosph. Ozon
> Deutsch > Climate Encyclopaedia > Obere Atmosphäre > Mehr > 2. Ozon > - Stratosph. Ozon
|
Obere AtmosphäreMehr .. |
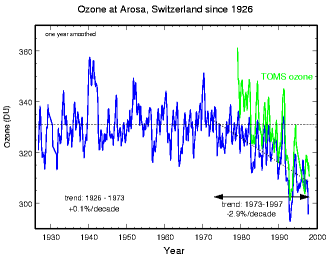
Stratosphärisches OzonUnser Wissen über das stratosphärische Ozon begann erst nach 1980 deutlich zu wachsen. Der Grund hierfür war die Entdeckung des Ozonloches im Jahr 1985. Die folgenden Abschnitte beschäftigen sich mit der Entdeckung des Ozons und der Erforschung seiner Chemie.
|
Entdeckung des Ozons und erste MessungenDie Ozonforschung ist im Grunde ein relativ alter Zweig der Atmosphärenwissenschaft. 1840 wurde das Gas durch den Chemiker Christian Friedrich Schönbein entdeckt und auf den Namen Ozon (= das Riechende) getauft. Er stellte fest, dass es durch elektrische Entladungen gebildet wird. Schon bald entdeckte man, dass es auch Bestandteil der natürlichen Luft ist. Die erste Methode zur Messung des Ozons wurde von Schönbein selbst entwickelt, kurz darauf aber am Observatorium Mt.Souris zu Paris verbessert. Von hier stammt auch die erste Serie von Messdaten (1876-1910), die heute als bester Anhaltspunkt für die Ozonkonzentration in den bodennahen Luftschichten zu Beginn der fortschreitenden Industrialisierung gilt.
|
|
|
1879 stellte man fest, dass das Lichtspektrum der Sonne im UV-B Bereich (Ultravioletttes Licht) die Erdoberfläche nur stark abgeschwächt erreicht und im Jahr darauf wurde klar, dass hierfür das Ozon verantwortlich ist, als ein starker Absorber (lichtaufnehmendes Molekül) in diesem Bereich. Die Menge an Ozon jedoch, die man in den bodennahen Luftschichten gemessen hatte, konnten alleine die Stärke der Abschwächung nicht erklären. Daher kam man schon bald zu der Vermutung, dass der Hauptteil des Ozons in höheren Luftschichten gebildet werden müsse. Die Schlüsselforschung wurde von Gordon Dobson in den 20er Jahren des 20. Jahrhunderts ausgeführt. Er entwickelte das Dobson-Spektrometer, das seit 1929 zur Messung der gesamten Ozonsäule in der Atmosphäre genutzt wurde. Die Geräte, obgleich nach und nach durch modernere Techniken ersetzt, sind bis heute in Gebrauch. Details, wie ein Dobson Spektrometer funktioniert (englisch), finden sich
|
|
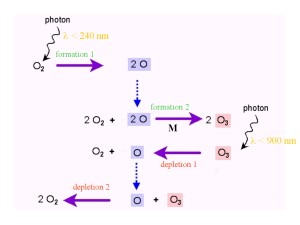
Chapman ReaktionenAber wie entsteht Ozon überhaupt und wie wird es wieder abgebaut? 1929 / 1930 veröffentlichte S. Chapman die Theorie der Bildung von Ozon und seines Abbaus. Die Reaktionen haben bis heute Gültigkeit und werden als ‚Chapman-Zyklus' oder 'Chapman-Reaktionen' bezeichnet. Normaler Sauerstoff und Ozon werden hierbei ineinander umgewandelt. Die Bindungen werden durch sogenannte Photolyse, d.h. Spaltung durch die Energie des Sonnenlichtes, gebrochen. Um die Bindung in einem Sauerstoffmokekül O2 zu brechen, ist eine größere Energie notwendig (Wellenlängen von weniger als 240 nm) als für die Spaltung eines Ozonmoleküls O3 (Wellenlänge kleiner als 900 nm). |
|
Bildung und Abbau stehen im Gleichgewicht. Das Ergebnis ist eine Nullreaktion (= gleichbleibende Konzentration). 3 O2 -> 2 O3 und 2 O3 -> 3 O2
|
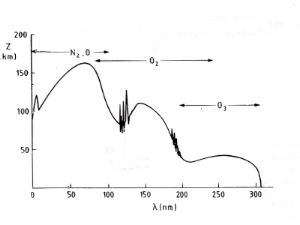
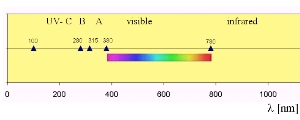
Absorption von UV-LichtEs hängt von den Absorptionseigenschaften eines Moleküls ab, ob eine Bindung durch reine Lichtenergie gebrochen werden kann. Jedes Molekül absorbiert in einem gewissen Bereich des elektromagnetischen Spektrums (kleinere Wellenlängen = höhere Energie). Sauerstoff absorbiert im hochenergetischen UV-C Bereich, Ozon im geringfügig energieärmeren UV-B Bereich. Längere Wellenlängen passieren teilweise die Atmosphäre und erreichen die Erdoberfläche, so auch das für unsere Augen sichtbare Licht.
|
|
5. Absorptionsspektra und Höhe
|
Ozonabbau durch RadikaleEs wurde mehr und mehr klar, dass die gemessenen Ozonkonzentrationen nicht alleine durch den einfachen Chapman-Zyklus erklärt werden können. Etwa von 1970 an entwickelten Crutzen, Molina und Rowland (Nobelpreis 1995) und andere Wissenschaftler eine Theorie, die den Einfluss von Stickoxiden und Halogenradikalen in die Ozonchemie mit einbezieht. Molina und Rowland entdeckten schon 1974, dass FCKW Ozon zerstören.
|
|
|
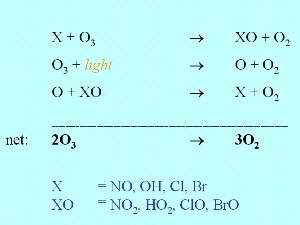
Ozon wird nicht alleine durch Photolyse abgebaut, sondern auch durch die Reaktion mit einer anderen Verbindung X
|
|
scientific reviewing: Dr. Christoph Brühl - MPI Chemistry, Mainz
educational proofreading: Michael Seesing - Uni Duisburg - 2003-08-07
Letzte Überarbeitung: 2007-08-23