> Français > Climate Encyclopaedia > haute atmosphère > Plus > 2. Ozone > - chimie du chlore
> Français > Climate Encyclopaedia > haute atmosphère > Plus > 2. Ozone > - chimie du chlore
|
Haute AtmosphèrePlus |
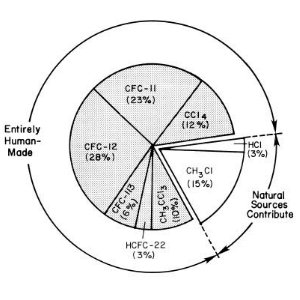
Chimie du ChloreLa production en masse de chlorofluorocarbons (CFC) a engendré l'émission de chlore dans l'atmosphère. Or ces molécules chlorées sont les pires ennemies de l'ozone. Mais pour détruire la couche d'ozone, il fallait que de multiples conditions très particulières soient réunies, et c'est à cause de cela que personne n'a vu arriver ce bouleversement dramatique...
|
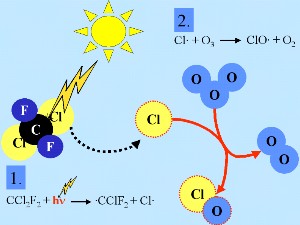
Stratospheric chlorine chemistry En général, comme beaucoup d'autres radicaux X X Cette reaction en chaîne conduit à la destruction de l'ozone.
|
|
Le radical initial X
|
|
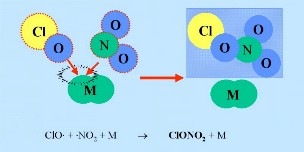
ClO HCl et ClONO2 sont appelés espèces réservoir, car le chlore qu'ils contiennent n'est pas actifs et ces espèces ne réagissent pas avec l'ozone. Ils sont normalement présents dans la phase gazeuse et disparaissent lentement de la stratosphère. Dans la chimie en phase gazeuse stratosphérique normale, seul une légère destruction de l'ozone a lieu. Cependant les espèces réservoir sont transportées vers la basse stratosphère en hiver, de part la circulation atmosphérique. |
|
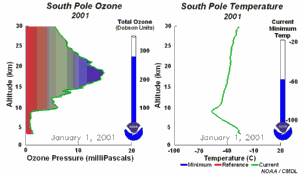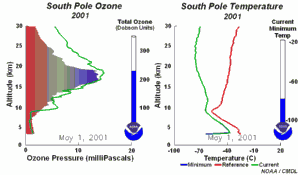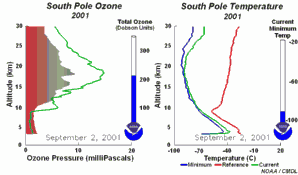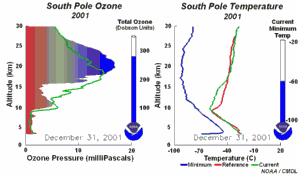
Les conditions particulières du trou d'ozone en AntarctiqueDurant la nuit polaire, la température de l'air peut descendre jusqu'à -80 °C. Dans ces conditions, le peu d'eau et d'acide nitrique présents dans la stratosphère gèlent (donnant du trihydrate d'acide nitrique) et des nuages stratosphériques polaires glacés se forment. Cinq conditions essentielles peuvent maintenant survenir en même temps:
|
|
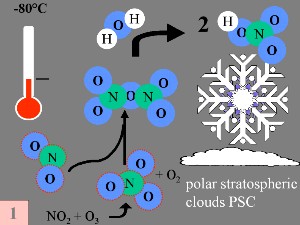
Premièrement: Le monoxyde d'azote NO et le dioxyde d'azote NO2, (qui permettent de convertir le ClO
Le produit de la réaction est l'acide nitrique HNO3 qui s'incorpore dans les nuages stratosphériques polaires (PSC).
|
|
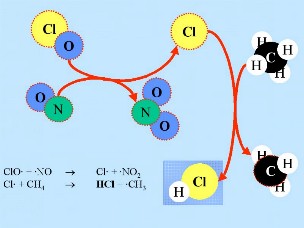
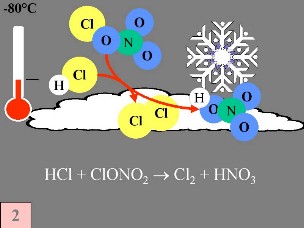
Deuxièmement: HCl et ClONO2 réagissent l'un avec l'autre à la surface des nuages stratosphériques polaires, pour donner Cl2 et HNO3. Cet acide nitrique est immédiatement incorporé dans les particules de glace du nuage. Quatrièmement: S'il n'y a aucun oxyde d'azote en présence, les radicaux de chlore commencent des réactions en chaîne, qui mènent à la destruction de l'ozone.
|
|
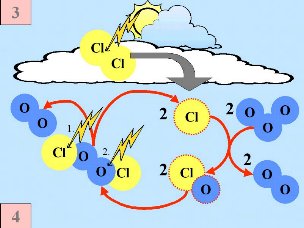
Quatrièmement: S'il n'y a aucun oxyde d'azote en présence, les radicaux de chlore commencent des réactions en chaîne, qui mènent à la destruction de l'ozone. Cl |
|
Cinquièmement: Normalement des espèces chlorées comme Cl
|
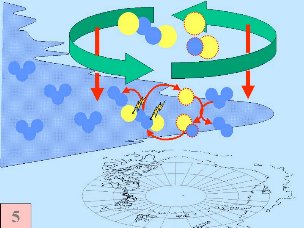
Ces cinq conditions doivent survenir ensemble pour former le trou d'ozone. C'est pourquoi la majeure zone de destruction de l'ozone se situe au-dessus des pôles (principalement le pôle Sud) et uniquement au printemps, dès que le soleil réapparaît après l'hiver polaire.
|
|
M: Dans toute réaction A + B - > C un troisième composé est nécessaire, pour emporter l'excès d'énergie. Sinon, le produit C aurait la même énergie que la somme des réactifs A + B et la réaction inverse se déroulerait tout de suite. Dans la plupart des cas M est le dioxyde d'azote (N2) de l'air.
|
A propos de cette page:
|