> Français > Climate Encyclopaedia > haute atmosphère > Bases > 2. Trou d'ozone > - trou d'ozone et CFC
> Français > Climate Encyclopaedia > haute atmosphère > Bases > 2. Trou d'ozone > - trou d'ozone et CFC
|
Haute AtmosphèreBases |
Le trou d'ozone et les chlorofluorocarbones CFCL'histoire du trou dans la couche d'ozone nous montre comment des composés chimiques apparemment sans danger ont pu se révéler être nocifs pour la vie sur Terre. C'est un bon exemple pour voir que les gouvernements, l'industrie et la société peuvent agir ensemble pour résoudre un problème.
|
|
Le trou dans la couche d'ozone nous a appris que les humains peuvent perturber l'équilibre climatique, et que si le monde entier se mobilise, les problèmes environnementaux peuvent être traités.
|
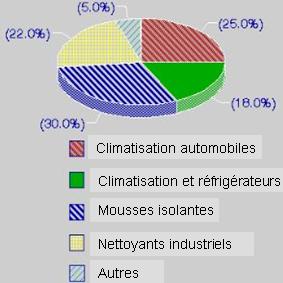
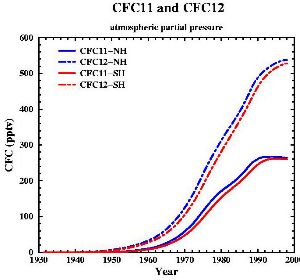
A quoi servent les CFC?Les chlorofluorocarbones, appelés CFC sont des composés contenant du carbone et des composés comme le fluor ou le chlore (par exemple CFCl3 ou CF2Cl2). Ils sont aussi connus sous le nom commercial de Fréons.
|
|
|
Que deviennent les CFC dans la stratosphère?La couche d'ozone bloque les rayons ultraviolets très énergétiques du soleil, et ceux qui arrivent jusque dans la troposphère sont donc trop faibles pour casser les CFC. Mais comme les CFC ont une durée de vie très longue, ils ont le temps de s'élever jusqu'à la stratosphère, là où les rayons UV sont assez forts pour casser les molécules de CFC et donner ainsi des espèces fluorées et chlorées. |
|
Cependant ces composés chlorés (qui sont les plus mauvais pour l'ozone) peuvent subir aussi d'autres réactions, en fonction des conditions météorologiques, et ne sont donc pas forcément "disponibles" pour nuire à l'ozone. De même, alors que la couche d'ozone se réduit partout à cause de ces composés, le trou d'ozone se forme seulement dans les régions polaires, en particulier au dessus de l'Antarctique pendant le printemps. Pour quelle raison ?
|
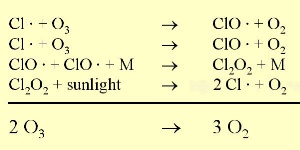
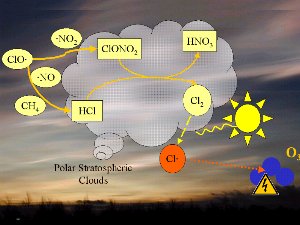
Les conditions nécessairesLa décomposition des CFC produit du monoxyde de chlore ClO. Celui-ci réagit ensuite avec le dioxyde d'azote NO2 pour former du nitrate de chlore (ClONO2)ou avec le monoxyde d'azote (NO) et le méthane pour donner des acides chlorydrique (HCl) et nitrique (HNO3). On ne détaillera pas la chimie ici, mais il faut savoir que ces deux produits (HCl et ClONO2) ne réagissent pas avec l'ozone et sont relativement stables.
|
|
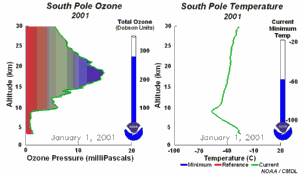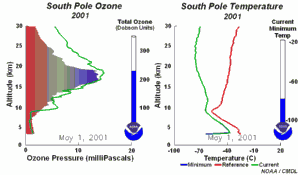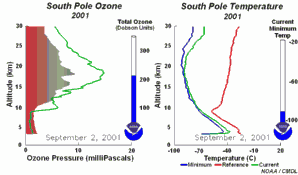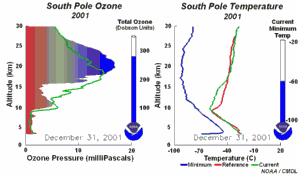
1) Tout d'abord, les températures de la stratosphère en Antarctique durant la nuit polaire sont extrêmement basses, de l'ordre de -80°C ou moins. Dans ces conditions, l'acide nitrique et l'eau, sous forme de cristaux, peuvent former des nuages stratosphériques glacés qui n'existent pas à plus haute température. A la surface de ces particules de glace HCl et ClONO2 réagissent ensemble pour former de l'acide nitrique et du chlore moléculaire Cl2. 2) Le chlore Cl2 est une molécule stable mais qui, sous l'effet du soleil, se sépare facilement en 2 atomes de chlore, qui attaquent l'ozone (flèche orange).
|
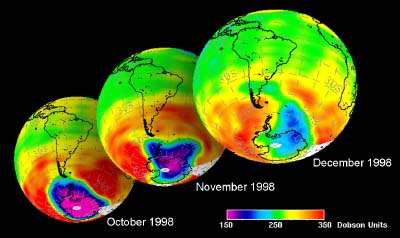
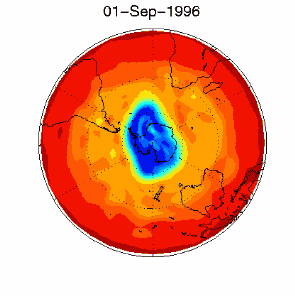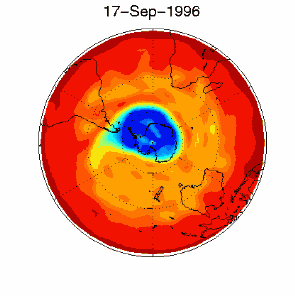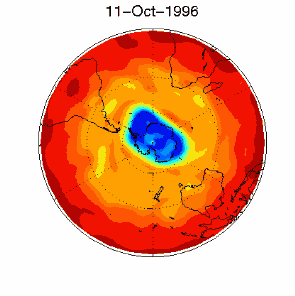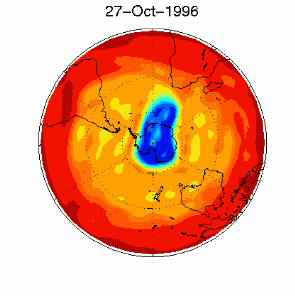
Nous avons vu que c'est le chlore atomique Cl qui est très nocif pour l'ozone. Durant l'hiver, il n'y a pas de soleil en Antarctique et la molécule de Cl2 ne peut pas se casser. Elle attend le printemps et le retour des ultraviolets, qui transforment cette molécule en chlore actif, capable de détruire l'ozone. C'est pour cela qu'on observe un trou dans la couche d'ozone, chaque année en Septembre et Octobre (printemps dans l'hémisphère sud). Cette destruction continue tant que les cristaux des nuages ne fondent pas et que le chlore actif n'est pas détruit par d'autres réactions. |
|
|
3) De plus, certaines conditions météorologiques favorisent la formation du trou. En effet, la formation du composé chloré ClO se fait à des altitudes très élevées, loin de celles où on trouve le plus d'ozone aux pôles (entre 14 et 22 km d'altitude). Malheureusement pour l'ozone, il existe en Antarctique ce qu'on appelle un vortex, qui sont des conditions météorologiques particulières. Des vents tournants autour du pôle transportent le ClO vers les altitudes plus basses où se trouvent les plus fortes concentrations d'ozone. |
|
Ces conditions de formation du trou:
sont si particulières que les scientifiques n'auraient pas pu prédire le trou s'ils ne l'avaient pas observé. |
Et dans le futur ?Les CFC ont été interdits suite au protocole de Montréal en 1987. A cause de leur durée de vie très longue dans l'atmosphère, il faudra environ 50 ans pour que les CFC disparaissent et que l'équilibre en ozone soit le même qu'avant. On a supposé que le trou serait de plus en plus grand jusqu'en 2000, puis que sa taille serait à peu près constante. Mais des exceptions sont possibles: en 2002, on n'a quasiment pas observé de trou dans la couche d'ozone, pour la simple raison que cette année fut très chaude et que le vortex polaire ne s'est pas formé comme d'habitude. Mais en 2003 le trou a retrouvé sa taille, il a même été le deuxième plus grand observé. Le climat ignore parfois toutes les prédictions!
|
|
A propos de cette page:auteur: Elmar Uherek - MPI Mainz
|
Liens recommandés :http://www.unep.org/ozone/pdf/qa.pdfwww.unep.org/ozone/faq/shtml
|