> magyar > Climate Encyclopaedia > Felső légkör > Haladó > 2. Ózon > - Sztratoszférikus. Ózon
> magyar > Climate Encyclopaedia > Felső légkör > Haladó > 2. Ózon > - Sztratoszférikus. Ózon
|
Felső légkörHaladó |
A sztratoszférikus ózon kémiájaCsak 1980 után történt, hogy a sztratoszférikus ózon kémiájáról ismereteink rohamosan növekedtek. Ennek az oka az 1985-ös ózonlyuk felfedezése volt. A következő két részben történeti keretben kitekintést adunk a sztratoszféra kémiájáról.
|
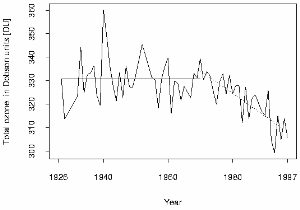
Az ózon felfedezése és az első mérésekAz ózon kutatás meglehetősen régi területe a légkör tudománynak. 1840-ben a gázt ’ózonnak’ (szagos) keresztelte Christian Friedrich Schönbein kémikus, aki felfedezte, hogy ez az anyag képződik elektromos kisülésekkor. Nagyon hamar kiderült, hogy az ózon a levegő természetes része. Ennek a gáznak az első mérési módszerét Schönbein fejlesztette ki, de nagyon hamar ezt továbbfejlesztették Párizsban, a Mt. Souris Obszervatóriumban. Onnantól kezdve származnak az első adatsorok (1876-1910), melyek ma a legjobb becslései az iparosodás előtti határrétegbeli koncentrációnak.
|
|
|
1879-ben felfedezték, hogy a Nap spektruma jelentősen lecsökken az UVB tartományban a Földi felszíne közelében, és 1880-ban felfedezték, hogy az ózon egy erős elnyelő ebben a tartományban, és az lehet felelős ezért. Az alsó légkörben megtalálható ózon mennyiség, azonban nem magyarázza meg ezt az UVB csökkenést. Ennek következtében megszületett a feltevés, hogy a legtöbb ózonnak magasabb légrétegekben kell képződnie. A kulcsfontosságú kutatást Gordon Dobson végezte el a XX. század 20-as éveiben. Kifejlesztette a Dobson - spektrométert, amit 1929 óta használunk a teljes légoszlop ózon mennyiségének megmérésére, és manapság ugyan fokozatosan helyettesítik sokkal modernebb eljárásokkal, de még mindig használják. Arról, hogy hogyan működik a Dobson spektrométer, többet itt találhatsz, kattints
|
|
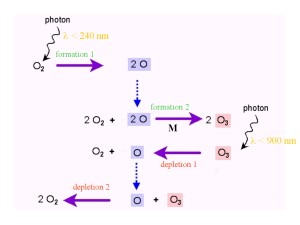
A Chapman reakció
3 O2 -> 2 O3 és 2 O3 -> 3 O2
|
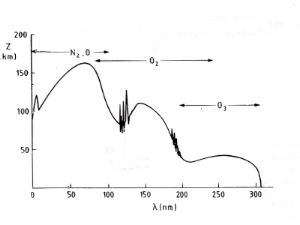
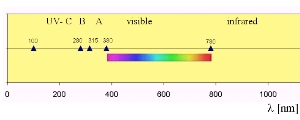
Abszorpció az UV tartománybanA molekula abszorpciójától függ, hogy egy molekulát csak tisztán fénnyel fel tudunk-e bontani. Minden molekula az elektromágneses spektrum bizonyos részének az energiáját elnyeli. Az oxigén abszorbeálja a nagyenergiájú UV-C tartományt, az ózon a valamivel kevésbé energikus UV-B-t. A hosszabb hullámhossztartományok részben áthaladnak a légkörön és elérik a Föld felszínét. 5. Abszorpciós spektrum (jobbra):
|
|
|
Az UV-B egy kis része azonban eléri a földfelszínt, hozzájárulva az OH gyök képződéshez, ami tisztítja a troposzférát. Ez a tartomány kritikus a biológiában is, beleértve lebarnulást vagy a DNS károsodását.
|
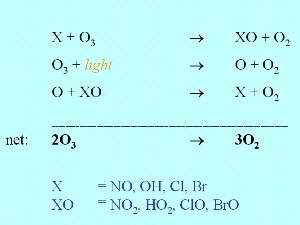
Gyökök miatti ózoncsökkenésEgyre világosabbá vált, hogy a mért ózonkoncentráció nemcsak az egyszerű Chapman reakciókkal magyarázható. 1970-től Crutzen, Molina, Rowland (Nobel díj, 1995) és más tudósok kidolgozták a halogén gyökök és nitrogén-oxidok részvételének elméletét az ózon kémiájában. Molina és Rowland már 1974-ben felfedezték, hogy a halogénezett szénhidrogének rombolják az ózont.
|
|
|
Az ózon nem csak fotolízissel bomlik el, hanem X• gyökökkel lezajló reakciójával is, mely lehet nitrogén–monoxid, NO, hidroxil–gyök, •OH vagy egy halogén gyök mint Cl• vagy Br•. Van több más olyan, kisebb a fontosságú gyök is, amelyek hasonló módon reagálnak. Mivel a halogént tartalmazó vegyületek kibocsátása emberi tevékenységből származik és ismert, csekély ózonkoncentráció csökkenést jósol néhány tudós. Azonban a sztratoszférára vonatkozó folyamatokról szóló ismereteink nem voltak teljesek, és egy ilyen nagymértékű ózoncsökkenést, mint az Antarktisz fölötti ózonlyuk nem vártak, mielőtt 1985-ben felfedezték azt.
|
Az oldalról:szerző: Dr. Elmar Uherek - MPI for Chemistry, Mainz
|