> Italiano > Climate Encyclopaedia > Bassa atmosfera > Principi > 3. Ozono e ossidi di azoto > - inquinamento da ozono
> Italiano > Climate Encyclopaedia > Bassa atmosfera > Principi > 3. Ozono e ossidi di azoto > - inquinamento da ozono
|
Bassa AtmosferaPrincipi |
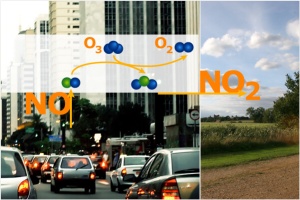
Inquinamento da OzonoL'inquinamento da ozono costituisce un problema serio in molte grandi città. L’accumulo di ozono fa parte di un complicato processo che vede coinvolti gli ossidi di azoto, la formazione di ozono e la sua distruzione. Il fenomeno dell’ inquinamento da ozono mostra chiaramente come i processi che avvengono nell'atmosfera siano interconnessi.
|
|
Un ulteriore problema può sorgere dalla automobili con motore diesel dotate di filtri anti particolato. Sebbene questi filtri trattengano le particelle dannose presenti nei gas di scarico, le automobili emettono più biossido di azoto (NO2). Al momento attuale (2008) non esiste sul mercato una tecnologia in grado di impedire le emissioni di particelle e di NO2 allo stesso tempo. |
|
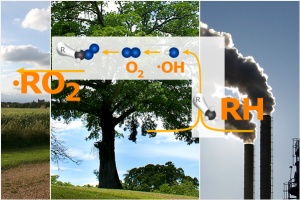
Da dove vengono i composti organici? Il secondo ingrediente necessario è la presenza di perossidi organici. Ma che cosa sono e da dove vengono? Le molecole organiche sono emesse dalle foreste e dalla vegetazione, così come da sorgenti antropogeniche (ad es. solventi o evaporazione di carburanti alle stazioni di rifornimento). Qui di seguito è riportata la struttura di alcuni composti organici, indicati col termine generico RH. Questi composti subiscono trasformazioni chimiche in fase gassosa. Durante il giorno, la reazione tipica è quella che coinvolge il radicale ossidrile (OH), seguita da addizione di una molecola di ossigeno (O2). Ne risulta la formazione di un radicale perossidico (RO2), dove R indica la parte organica non reattiva della molecola. Le specie radicaliche hanno un elettrone spaiato che le rende estremamente reattive.
|
|
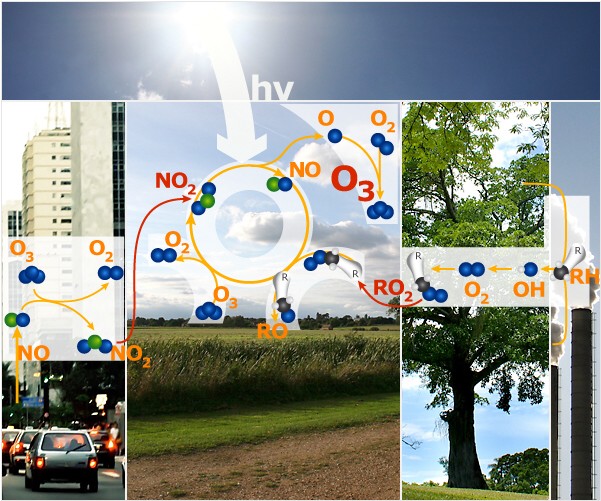
Dove abbiamo le condizioni ideali perché si produca inquinamento da ozono? Il ciclo di formazione dell'ozono ha inizio nelle aree rurali, sottovento rispetto alle città: 1) Il biossido di azoto (NO2) è distrutto dalla radiazione solare per formare atomi di ossigeno (O) e monossido di azoto (NO). 2) Gli atomi di O reagiscono con l’ossigeno molecolare gassoso (O2) per formare l'ozono (O3). 3) NO reagisce con i radicali perossidici RO2 per formare di nuovo. NO2 4) Parte dell’ O3 è rimosso in seguito alla reazione con NO. La quantità che viene rimossa dipende dalla concentrazione dei radicali RO2 che competono per la reazione con NO. |
|
Alla fine i radicali perossidici sono distrutti e l'ozono si accumula mentre gli ossidi di azoto sono riciclati di continuo. Questo ciclo di verifica solo se: a)C'è abbastanza luce solare da degradare NO2 in NO e O (la reazione ha luogo nei giorni caldi di sole). b)Se la miscela di radicali perossidici e ossidi di azoto favorisce la reazione.
|
|
|
|
Se gli ossidi di azoto non sono disponibili il ciclo di reazione non può avere luogo. Se le concentrazioni di ossido di azoto sono molto alte, NO reagisce non solo con i radicali perossidici ma anche con l'ozono e ciò implica la rimozione dell'ozono dal sistema. Se non c'è il sole, NO non può essere riciclato e non si formano abbastanza radicali perossidici da mantenere attivo il ciclo di reazioni.. Le concentrazioni di ossido di azoto sono generalmente abbastanza basse da prevenire il verificarsi di gravi fenomeni di inquinamento da ozono ma se continueremo ad emetterli durante i processi di combustione, è probabile che i fenomeni di inquinamento da ozono aumentino. Una situazione simile è quella che si osserva nel pennacchio degli incendi della vegetazione quando le temperature generate in queste incendi sono sufficientemente elevate da permettere la formazione di ossido di azoto. Pagine collegate Scopri di più su come vengono controllati i livelli di ozono troposferico in: Impara di più sui problemi derivanti dai filtri anti-particolato montati su veicoli diesel dal
|
A proposito di questa pagina:Versione italiana: Laura Dini (traduttore) e Michela Maione (revisione linguistica)
|