> ACCENT it > No 6 Feb. 2006 piogge acide > C: La formazione degli acidi
> ACCENT it > No 6 Feb. 2006 piogge acide > C: La formazione degli acidi
|
Contesto 1: L'ossidazione dello zolfo e la formazione degli acidi
|
|
Gran parte degli ossidi di zolfo si formano durante la combustione dello zolfo o attraverso l'ossidazione atmosferica dei composti solforati. In aria questi composti reagiscono formando particelle di acido solforico. Le piogge acide rappresentano un problema ambientale dovuto principalmente al rilascio di ossidi di zolfo (anidride solforosa e solforica) in seguito ad attività antropiche. Gli ossidi di azoto svolgono un ruolo altrettanto importante nella formazione delle piogge acide. |
In natura l'anidride solforosa è presente nei gas vulcanici e come prodotto dell'ossidazione del dimetilsolfuro (DMS) emesso dal fitoplancton marino (alghe) o di altri composti solforati formati dai micro-organismi. Quest'ultimo processo viene descritto nella rivista rivista nr. 5 (zolfo marino). Inoltre, l'anidride solforosa si forma dalla combustione di combustibili contenenti zolfo, quale il carbone, il petrolio per riscaldamento e l'olio pesante usato nei motori delle navi. Queste fonti sono tutte legate ad attività antropogeniche. |
|
|
Tabella: emissioni di zolfo nel mondo
> Il 90% di tutte le emissioni biogeniche sono DMSL'anidride solforosa può distruggere i pigmenti ed è per questo che viene usata come decolorante nel settore industriale. L'effetto disinfettante dell'anidride solforosa viene spesso sfruttato per conservare gli alimenti (ad esempio nella frutta secca). |
|
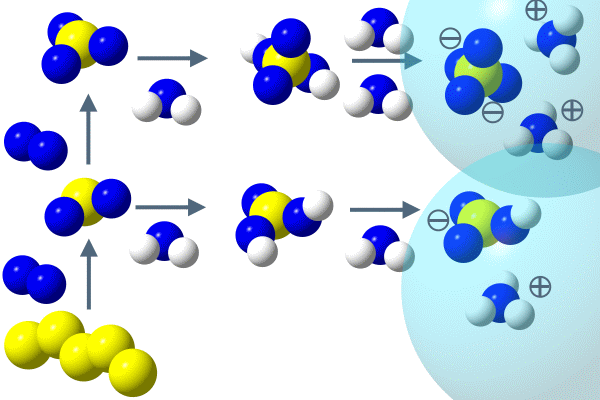
Quando l'anidride solforosa si scioglie in acqua forma una soluzione leggermente acida di l'acido solforoso. H2O + SO2
|
|
La solubilizzazione di acido solforico nelle gocce di pioggia aumenta la concentrazione di protoni, riducendo i valori di pH ed aumentando l'acidità della pioggia. Le piogge acide non solo dissolvono alcune rocce (quelle carbonatiche) ma attaccano anche le superfici metalliche e mobilizzano certi ioni del terreno, tossici per le piante. Ne conseguono danni agli edifici, agli oggetti metallici, alle foreste e l'acidificazione dei laghi. Per avere maggiori informazioni sulle piogge acide consultare la sezione link.
|
|
|
|