> ACCENT de > Nr 6 Feb. 2006 Saurer Regen > C: Bildung von Säuren
> ACCENT de > Nr 6 Feb. 2006 Saurer Regen > C: Bildung von Säuren
|
Kontext 1: Die Oxidation von Schwefel und die Säurebildung
|
|
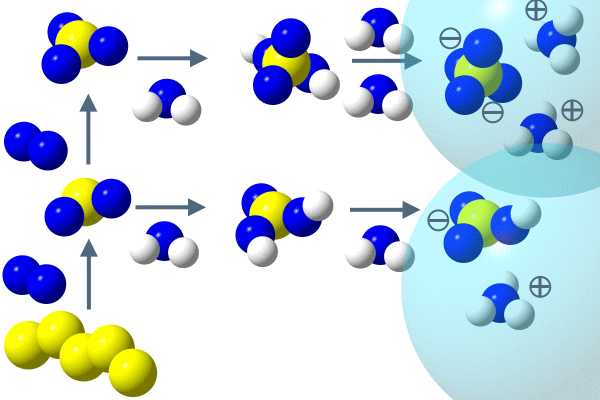
Schwefeloxide entstehen vor allem bei der Verbrennung von Schwefel oder der Oxidation von Schwefelverbindungen. In der Luft werden sie zu Schwefelsäure-Partikeln. Kommen sie mit Wasser in Berührung, so bilden sich Säuren. Ein Umweltproblem, das vor allem auf die starke Freisetzung von Schwefeloxiden (Schwefeldioxid und Schwefeltrioxid) aus menschlicher Aktivität zurückzuführen ist, ist der saure Regen. Freilich spielen beim sauren Regen auch Stickoxide eine Rolle.
|
In der Natur kommt Schwefeldioxid in Vulkangasen vor sowie als Produkt der Oxidation von Dimethylsulfid aus ozeanischem Phytoplankton (Algen). Letzteres ist im ACCENT Magazin Nr. 5 (ozeanischer Schwefel) beschrieben.
|
|
|
Tabelle: Weltweite Schwefelemissionen
> 90% aller biogenen Emissionen sind DMS.
|
|
Gelangt Schwefeldioxid in Wasser, bildet es eine saure Lösung, die Schweflige Säure: H2O + SO2
|
|
Der Eintrag von Säure in das Wasser der Regentropfen erhöht dessen Protonenkonzentration, d.h. der pH-Wert sinkt. Der Regen wird sauer. Saurer Regen aber löst nicht nur manche Gesteine auf (z.B. Carbonatgesteine), sondern greift auch Metalloberflächen an und löst gewisse Giftstoffe aus dem Boden, die die Pflanzen schädigen. Es kommt zu Schäden an Gebäuden und außen stehenden Metallgegenständen ebenso wie zur Versauerung von Seen und Schädigung von Wäldern. Weitere Informationen zum sauren Regen erhältst du aus den in der Linkliste angegebenen Webseiten.
|
|
|
|