> ACCENT ru > № 6 Февраль 2006 кислотные дожди > К: Образование кислот
> ACCENT ru > № 6 Февраль 2006 кислотные дожди > К: Образование кислот
|
Контекст 1: окисление серы и образование кислот
|
|
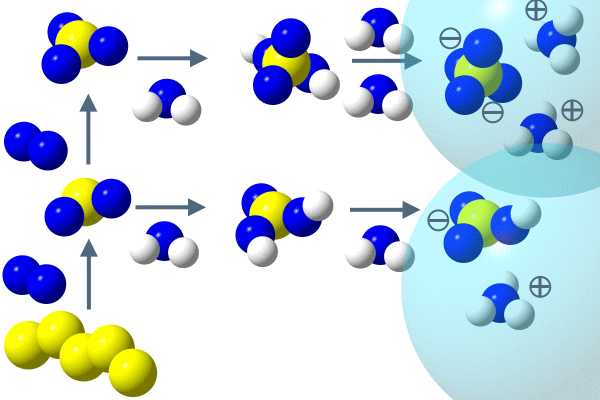
Оксиды серы, прежде всего, образуются путем сгорания серы или окисления соединений серы. В воздухе они превращаются в частицы серной кислоты. Кислотные дожди – экологическая проблема, главным образом связанная с выпадением оксидов серы (двухокись и трёхокись серы) в результате деятельности человека. В формировании кислотных дождей также играют роль оксиды азота.
|
Двухокись серы в естественном состоянии бывает в вулканических газах, а также как продукт окисления диметилсульфида из океанского фитопланктона (водорослей) или других серных соединений, образованных микроорганизмами. Последние два процесса описаны в журнале ACCENT № 5 (сера океана).
|
|
|
Таблица: Эмиссия серы в мире
> 90 % всей биогенной эмиссии – DMS.
Двухокись серы может разрушать пигменты. Поэтому, в промышленности ее используют как отбеливающий реагент. Дезинфицирующий эффект двухокиси серы часто используют для консервирования продуктов питания (например, при сушке плодов). |
|
Если двухокись серы растворить в воде, получаем слабый раствор кислоты или так называемую сернистую кислоту. H2O + SO2
|
|
Раствор серной кислоты в дождевой воде снижает концентрацию некоторых ионов, т.е. уменьшает pH. Дождь становится более кислым. Кислотные дожди разрушают некоторые камни (известняк), металлические поверхности, а также активизируют в почве ионы, которые являются ядовитыми для растений. Последствия – ущерб зданиям, металлическим конструкциям, закисление озер и повреждение лесов. Больше подробной информации относительно кислотных дождей вы найдете в разделе Ссылки.
|
|
|
|