|
|
 |
|
|
|
 |
| |
|
|
 |
Baixa Atmosfera
Ler mais |
As condições nocturnas e a química
A química que ocorre na atmosfera não depende apenas dos compostos libertados emitidos, mas também nas condições da atmosfera. Esta última, no entanto, é definida pelas estações do ano, pelas variações do dia e noite, pelo perfil de temperatura, pela humidade, ... |
|
|
|
|
 |
 |
 |
|
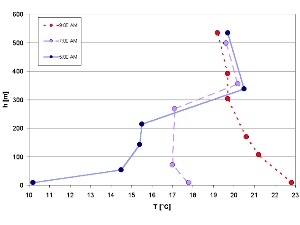
1. Inversão de temperatura a dissolver-se numa manhã de Julho (medida em Vale Isar / Alemanha)
por Elmar Uherek adaptado de Schirmer - Wetter und Klima - Wie funktioniert das?
Prima para aumentar (50 Kb)!
|
|
 |
O ciclo diurno
Na última secção aprendemos acerca do ciclo diurno do OH, que depende da radiação solar. Mas não só os químicos possuem ciclos diurnos, também as condições da atmosfera como é exemplo o perfil da temperatura. As condições próximas do solo chamadas de camada limite da atmosfera variam e nem sempre seguem as regras gerais (por exemplo a diminuição da temperatura com o aumento da temperatura) por causa das interacções da superfície da Terra. Um exemplo típico é a camada de inversão nocturna que desaparece com o amanhecer.
|
A inversão nocturna na camada limite planetária
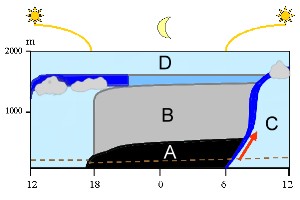
As massas de ar abaixo da atmosfera livre troposférica (D) pertencem à camada limite planetária. Algumas alterações ocorrem durante o dia (da esquerda para a direita): Ao meio-dia o ar é misturado (azul claro). Depois do pôr-do-sol forma-se uma camada estável nocturna (A) e o ar residual permanece acima (B). O ar da camada de superfície (abaixo da linha de pontos castanha) não pode ir com facilidade para cima para altitudes mais elevadas durante a noite. Não possui energia para efectuar esse movimento. Essa energia volta com o nascer-do-sol. O solo aquece, o ar começa a sua ascensão (seta vermelha), a camada estável proveniente da noite quebra-se. Uma zona de mistura cresce a partir do solo até ao topo da camada limite (azul escuro) e deixa o ar bem misturado durante o dia (C).
|
 |
 |
 |
|
2. Modelo da camada limite planetária. A espessura da camada limite planetária pode variar.
por Elmar Uherek, adaptado de Stull 1988
Prima para aumentar! (70 Kb)
|
|
Em tempo de inverno pode acontecer, que o sol não é capaz de dissolver a camada de inversão em todo o dia ou até durante vários dias. Em tais casos a poluição acumula sobre as cidades e leva à formação do smog. Existem também condições muito especiais em vales de montanha, como mostra a figura da direita. A inversão permanece abaixo da camada de nuvens.
|
 |
 |
 |
|
3. Camada de inversão no inverno nas montanhas
© Inst. for geographical education, Univ. of Erlangen-Nürnberg
|
|
 |
 |
|
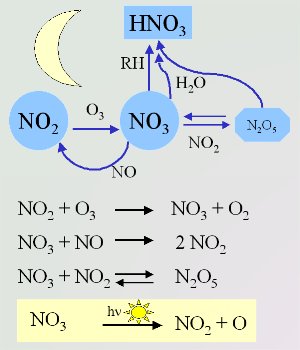
4. Importantes reacções com nitratos à noite (a fotólise durante o dia na caixa amarela)
Esquema por Elmar Uherek
|
|
 |
A química do Nitrato
Devido a diferentes condições nocturnas, também a química é diferente. Existe menor número de fontes de OH e os radicais de nitratos passam por reacções comparáveis com espécies orgânicas tal como OH tem durante o dia. Os radicais nitrato NO3 são formados a partir da reacção do ozono O3 com o dióxido de azoto NO2 (Unidade básica 3). Este reage de volta com NO. Esta é a razão porque NO e NO3 não pode co-existir em elevadas concentrações. A reacção de NO3 e NO2 é o único caminho para formar N2O5 na atmosfera. Este pode ser sujeito a hidrólise em água ou decompor-se novamente em NO2 e NO3.
De forma idêntida com oOH, os radicais de nitrato retiram um átomo H dos alcanos. O ácido nítrico HNO3 e radicais alcalóides R formados reagem com o oxigênio do ar e formam os radicais peróxidos RO2 formados reagem com o oxigênio do ar e formam os radicais peróxidos RO2 . . |
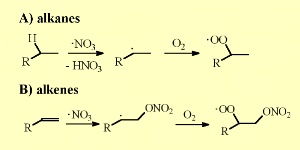
NO3 adiciona também ligações duplas a compostos orgânicos não saturados e forma peróxidos nitratos depois da adição de O2.
É de algum interesse o tempo de vida de NO3 / N2O5 que diminui dramaticamente com o aumento do vapor de água. HNO3 é formado a partir da reacção com a água, em particular em filmes líquidos em superfícies.
Todas as espécies de peróxidos, provenientes de  OH, NO3 ou reacções de ozono passam por reacções bastante complicadas e numerosas na atmosfera com O2, HO2 OH, NO3 ou reacções de ozono passam por reacções bastante complicadas e numerosas na atmosfera com O2, HO2 , RO2 , RO2 , NO ou NO2 levando por exemplo a álcool, aldeídos, nitratos e ácido carboxílico. Isto fica muito longe do âmbito desta introdução para todas estas reacções, que foram só parcialmente investigadas. , NO ou NO2 levando por exemplo a álcool, aldeídos, nitratos e ácido carboxílico. Isto fica muito longe do âmbito desta introdução para todas estas reacções, que foram só parcialmente investigadas.
|
 |
 |
 |
|
5. Reacções de Nitratos com alcanos e alcenos
Prima para aumentar (30 Kb)!
|
|
 |
 |
|
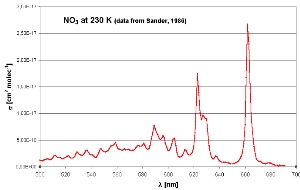
6. Espectro de absorção de nitrato na gama do visível com o máximo na parte vermelha do espectro (600-700 nm)
adaptado de Sander (1986), medido a 230 K
|
|
 |
NO3 absorve luz nas parte correspondente ao comprimento de onda do vermelho do espectro visível. Assim que a luz do dia aparece, é fotolisado principalmente para NO2 e O e a química de OH domina novamente. O ozono, o terceiro oxidante mais importante na atmosfera, não é possível reagir com os alcanos mas pode competir com os alcenos se as concentrações de OH diminuem sob condições de luz muito baixas (inverno e fim do dia). Um capítulo especial será dedicado com as reacções do ozono.
|
About this page:
author: Dr. Elmar Uherek - MPI for chemistry, Mainz
scientific reviewer: Dr. Mark Lawrence - MPI for chemistry, Mainz 2004-05-05
educational proofreading: Michael Seesing - Uni Duisburg - 2003-07-02
revised and last published: 2004-05-07
|
|
 |
|







