|
|
 |
|
|
|
 |
| |
|
|
 |
Obere Atmosphäre
Basis |
Zusammensetzung der Stratosphäre
Viele der Substanzen, die an der Erdoberfläche in die Luft entlassen werden, erreichen niemals die Stratosphäre. Entweder werden sie von den Hauptoxidationsmitteln der Troposphäre zersetzt (OH, NO3, Ozon), vom Sonnenlicht gespalten (Photolyse), trocken abgelagert oder vom Niederschlag ausgewaschen oder aber in der kalten Tropopause festgehalten. |
|
|
|
|
 |
|
Durch die Temperaturumkehr an der Tropopause ist der Luftaustausch zwischen Troposphäre und Stratosphäre gering. Während sich die Luft in der Troposphäre innerhalb von wenigen Stunden oder Tagen austauschen kann, dauert dieser Prozess für die Stratosphäre Monate oder Jahre.
|
Eine wichtige Folge ist, dass der Wasserdampfgehalt in der Stratosphäre sehr gering ist. Typische Mischungsverhältnisse (Definition siehe unten) liegen im Bereich von 2-6 ppm (parts per million = millionstel Anteile), verglichen mit 1.000 bis 10.000 ppm in der Troposphäre. Daher ist die Bildung stratosphärischer Wolken sehr selten und erfordert extrem niedrige Temperaturen (bis zu -80°C), damit auch das letzte Wasser noch in Eiskristallen ausfriert. Solche Bedingungen sind vor allem in den Polarregionen gegeben, in denen polare Stratosphärenwolken (PSC = polar stratospheric clouds) gebildet werden können. Der Wassergehalt der Stratosphäre kann durch den Luftverkehr ansteigen, zudem führt die Erwärmung der Troposphäre zu einer Temperaturerniedrigung in der Stratosphäre. Daher ist es nicht auszuschließen, dass sich zukünftig mehr Stratosphärenwolken bilden werden.
|
 |
 |
 |
|
1. Polare Stratosphärenwolken über Kiruna / Schweden
Quelle: MPI Heidelberg - Vollgröße: 35 K
|
|
Anorganische Substanzen in der Stratosphäre
Die stratosphärische Chemie ist vor allen Dingen von Ozon geprägt. 85-90% allen Ozons in der Atmosphäre befinden sich in der Stratosphäre. Dieses Spurengas bildet sich durch Lichtspaltung (Photolyse) von Sauerstoff in der Stratosphäre selbst, während viele andere Gase auf Grund ihrer langen Lebenszeit allmählich aus der Troposphäre eindringen, z.B. Distickstoffmonoxid N2O (Lachgas), Methan CH4 und Fluorchlorkohlenwasserstoffe (FCKW). Andere Substanzen werden durch starke Vulkanausbrüche in die Stratosphäre geschleudert (Schwefelverbindungen und Aerosole). Darum sind es die anorganischen Verbindungen, die das Spektrum stratosphärischer Spurengase dominieren: Stickoxide, Salpetersäure (HNO3), Schwefelsäure, Ozon, Halogene (Chlor, Brom) und Halogenoxide aus dem Abbau der FCKW und teilhalogenierten Kohlenwasserstoffe.
|
 |
 |
|
2. Der Ausbruch des Mt. Pinatubo / Philippinen im Juni 2001.
Quelle: Cascades Volcano Observatory USGS, Photo by Rick Hoblitt
|
|
 |
Vulkanausbrüche
Schwere Vulkanausbrüche können große Mengen an Gasen und Partikeln bis hinauf in die Stratosphäre schleudern. Solche Gase sind Halogensäuren wie Salzsäure (HCl) und Flusssäure (HF) oder Schwefeldioxid (SO2), welches zu Schwefelsäure (H2SO4) oxidiert wird. Schwefelsäure ist einer der wichtigen Auslöser der Wolkenbildung.
Die Partikel bestehen vor allem aus anorganischen Stoffen: Silicate, Halogensalze und Sulfate. Sie können das Sonnenlicht bereits in der Stratosphäre absorbieren und damit vorübergehend zu einer Erwärmung der Stratosphäre und einer Abkühlung der Troposphäre führen. Ein solcher Einfluss kann 1-2 Jahre andauern und auf der gesamten Erdhalbkugel gemessen werden, wie ab dem Juni 1991 beim Ausbruch des Mt. Pinatubo auf den Philippinen.
|
Konzentrationen und Mischungsverhältnisse
Wir können die Menge einer Substanz in der Atmosphäre auf zwei Arten beschreiben, relativ und absolut.
a) Mischungsverhältnis = der Anteil dieser Komponente an allen Luftmolekülen. Liegen 40 Ozonmoleküle in 1 Mio. Luftmolekülen vor, so ist das Mischungsverhältnis 40 ppm (parts per million = millionstel Anteile). Dies ist relativ.
b) Konzentration = Masse der Moleküle dieser Komponente in einem bestimmten Luftvolumen. Sind z.B. 100 µg Ozon in einem Kubikmeter Luft enthalten, so beträgt die Konzentration 100 µg/m3. Dies ist absolut.
Beide Angaben können mit Hilfe des Luftdruckes ineinander umgerechnet werden.
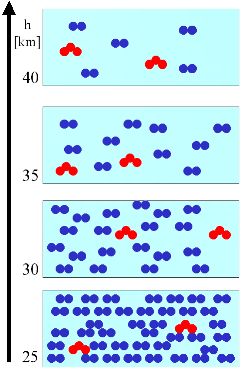
Der Druck ändert sich mit der Höhe. Dies bedeutet, je höher wir in der Stratosphäre sind, desto weniger Luftmoleküle (also vor allem Stickstoff und Sauerstoff) finden wir in einem Kubikmeter Luft. Dies bedeutet z.B. für ein Spurengas wie Ozon: Bleibt die absolute Masse und Zahl an Ozonmolekülen mit der Höhe in etwa gleich, so steigt der relative Anteil des Ozons an der Luft. Wir erklären dieses allgemeine Prinzip an einem sehr einfachen Beispiel. In einem bestimmten Volumen an Luft (hellblauer Kasten) sei eine bestimmte Anzahl an Luftmolekülen (blau) und eine bestimmte Anzahl an Ozonmolekülen (rot). Die Anzahl der Luftmoleküle sinkt immer mit zunehmender Höhe.
|
 |
 |
|
3. (L1) In diesem linken Beispiel nehmen wir nun an, dass die Menge an Ozonmolekülen [Konzentration = Molküle/Volumen = Masse/Volumen, Einheit z.B. Moleküle/m3, hPa, µg/m3] über alle Höhen hinweg dieselbe bleibt. (Rote Dreiecke im Konzentrationsprofil unten). Relativ zu den Luftmolkülen (blaue Kreise), die ja nicht gleich bleiben, sondern mit der Höhe weniger werden, steigt das Mischungsverhältnis Ozon zu Luft, das mit grünen Rauten dargestellt ist [Einheit z.B.: %, ppm = µmol/mol, ppb = nmol/mol, ppt = pmol/mol].
Zur Vergrößerung bitte anklicken!
|
|
 |
 |
 |
|
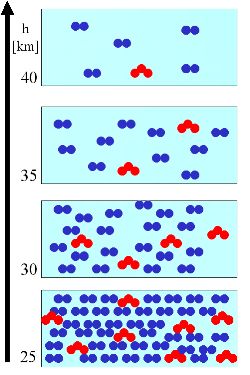
3. (R1) In diesem rechten Beispiel nehmen wir an, die Ozonmoleküle nehmen in gleicher Weise mit der Höhe ab, wie die Luftmoleküle. Das Mischungsverhältnis (Moleküle Ozon zu Moleküle Luft) bleibt also über die alle Höhen dasselbe (grüne Rauten unten): 8/40, 4/20, 2/10, 1/5 = 0,2 oder 20%. Die absolute Anzahl an Ozonmolekülen, d.h. die Konzentration (rote Dreiecke) nimmt mit der Höhe ab.
Zur Vergrößerung bitte anklicken!
|
|
 |
 |
|
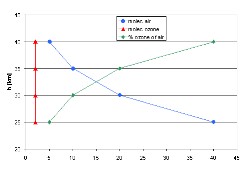
3. (L2) Einfaches Ozonprofil für das obige Beispiel - Konzentration (rot) und Mischungsverhältnis (grün).
Bitte zum Vergrößern anklicken!
|
|
 |
 |
 |
|
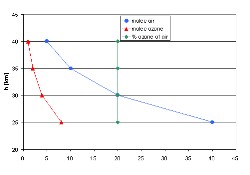
3. (R2) Einfaches Ozonprofil für das obige Beispiel - Konzentration in rot und Mischungsverhältnis in grün.
Bitte zum Vergrößern anklicken!
|
|
|
Was ist in der Realität der Fall? Das rechte Beispiel ist nur oberhalb des Maximums der Ozonschicht realistisch. Vom Erdboden bis zur unteren Stratosphäre ist das linke Beispiel eine gute Beschreibung. Die Konzentration bleibt ungefähr dieselbe, aber da die umgebende Luft dünner wird, steigen auch die Mischungsverhältnisse. Innerhalb der unteren Stratosphäre steigt sogar die Konzentration. Das Beispiel unten zeigt einen Anstieg um etwa einen Faktor acht.
|
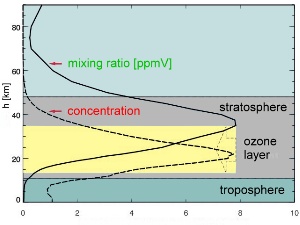 |
 |
|
4. Ozonprofil, Quelle: IUP Bremen
|
|
 |
In wissenschaftlichen Veröffentlichungen werden beide Darstellungen des Ozonprofiles genutzt, die rote wie auch die grüne. Hierbei muss aber bedacht werden, dass Ozon nicht eines von fünf Molekülen in der Luft ist, wie in obigem Beispiel gezeigt, sondern eher eines von einer Million Molekülen [1 ppm].
4. Die Abbildung links zeigt das Ozonprofil für Konzentrationen und für Mischungsverhältnisse in einer überarbeiteten Grafik.
Bitte zum Vergrößern anklicken!
Originalquelle: IUP Bremen
|
About this page:
Author: Dr. Elmar Uherek, Max Planck Institute for Chemistry, Mainz
Scientific reviewer: Dr. John Crowley, Max Planck Institute for Chemistry, Mainz - 2004-05-04
Educational proofreading: Michael Seesing - Univ. of Duisburg, Dr. Ellen K. Henriksen - Univ. of Oslo, Yvonne Schleicher - Univ. of Erlangen-Nürnberg
Letzte Überarbeitung: 2007-08-22 |
|
 |
|







