|
|
 |
|
|
|
 |
| |
|
|
 |
Untere Atmosphäre
Basis |
Ozonsmog
Ozon ist ein Bestandteil stark verschmutzter Luft in den Städten. Die Bildung erfolgt in einem komplizierten Prozess, an dem Stickoxide, Ozonbildung und gleichzeitiger Ozonabbau beteiligt sind. Es ist ein gutes Beispiel dafür, wie verschiedene Reaktionen in der Atmosphäre miteinander verknüpft sind.
|
|
|
|
|
 |
 |
 |
|
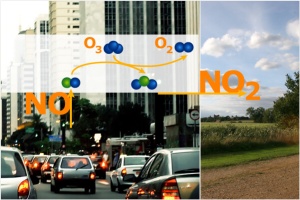
1. NOx Emissionen in der Stadt
Bild: Anja Kaiser © ESPERE
Bitte das Bild zum Vergrößern anklicken!
|
|
 |
Was geschieht in der Stadt?
Wählen wir ein einfaches Beispiel und nehmen an, alle Stickstoffoxide kommen aus den Verbrennungsprozessen in Autos. NO (Stickstoffmonoxid*) reiche Luft steigt von den Straßen und Autobahnen hoch. Was zunächst stattfindet, ist nicht etwa eine Bildung, sondern ein Verbrauch von Ozon. Denn NO wird durch Ozon oxidiert und bildet dabei Stickstoffdioxid (NO2). Und in der Tat sind direkt über den Straßen und in der Nähe der Autobahn die Ozonkonzentrationen oft sehr niedrig. Während einer Ozonsmog-Periode kann die Ozonkonzentration in der Stadt niedriger sein, als im ländlichen Raum um die Stadt herum. Die Abgasfahnen von NOx reicher Luft werden mit dem Wind auf das Land hinausgetrieben.
[*Zur Nomenklatur der Stickstoffverbindungen siehe auch Artikel Stickoxide]
|
|
Durch den zunehmenden Einbau von Partikelfiltern in Diesel-Fahrzeuge, die Gesundheitsschäden durch Feinstaub verhindern sollen, stellt sich derzeit noch ein weiteres Problem. So ausgerüstete Autos geben mehr an Stickstoffdioxid (NO2) ab. Bislang gibt es noch keine marktübliche Technik, die die Abgabe von Partikeln und NO2 bei Dieselfahrzeugen gleichzeitig verhindert.
|
 |
 |
|
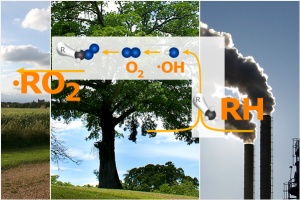
2. Organische Emissionen aus Wald und Industrie
Bild: Anja Kaiser © ESPERE
Bitte zum Vergrößern anklicken!
|
|
 |
Woher kommen die organischen Verbindungen?
Der zweite Partner, der zur Ozonbildung benötigt wird, sind organische Peroxide (stark oxidierte reaktive Verbindungen). Woher kommen sie? Organische Moleküle werden von den Wäldern und anderen Pflanzen emittiert. Sie kommen aber auch aus menschlichen Quellen (z.B. aus Lösemitteln oder dem Benzin der Tankstellen). Im Bild zeigen wir die Struktur einiger organischer Verbindungen, die wir mit RH abkürzen. Die Verbindungen werden in der Luft chemisch angegriffen. Die typische von Sonnenlicht begünstigte Reaktion ist diejenige, mit dem Hydroxylradikal  OH. Im Anschluss lagert sich ein Sauerstoffmolekül an. Das Ergebnis ist ein Peroxi-Radikal RO2 OH. Im Anschluss lagert sich ein Sauerstoffmolekül an. Das Ergebnis ist ein Peroxi-Radikal RO2 . R steht hierbei für einen oganischen Rest desjenigen Teils des Moleküls, der nicht an der Reaktion teil hat. Radikale haben ein einzelnes Elektron, was durch den Punkt symbolisiert wird. Dieses macht sie sehr reaktiv. . R steht hierbei für einen oganischen Rest desjenigen Teils des Moleküls, der nicht an der Reaktion teil hat. Radikale haben ein einzelnes Elektron, was durch den Punkt symbolisiert wird. Dieses macht sie sehr reaktiv.
|
 |
 |
|
3. Bildung von Ozonsmog
Bild: Anja Kaiser © ESPERE
Bitte zum Vergrößern anklicken!
|
|
 |
Wann sind die besten Bedingungen für Ozonsmog?
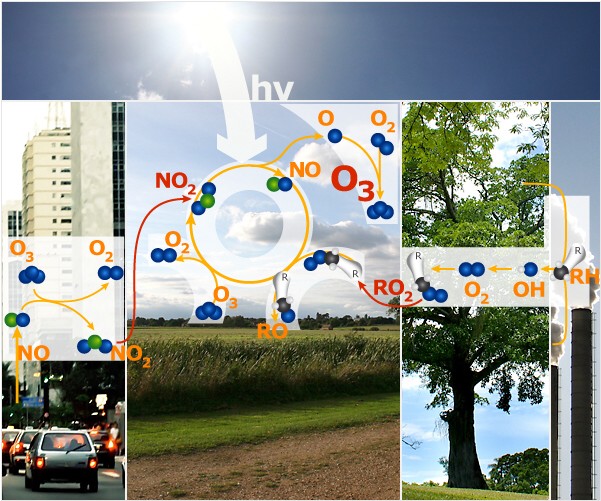
Über den ländlichen Gebieten rund um die Stadt herum kann nun die Bildung von Ozon beginnen:
1) Stickstoffdioxid NO2 wird vom Sonnenlicht gespalten und bildet O-Atome sowie Stickstoffmonoxid NO.
2) Die O-Atome reagieren mit normalem Sauerstoff (O2) in der Luft und bilden Ozon (O3).
3) NO wiederum reagiert mit Peroxi-Radikalen RO2 und bildet NO2 zurück. und bildet NO2 zurück.
4) Ein Teil des gebildeten Ozons kann wieder von NO verbraucht werden, je nachdem, wie viel konkurrierende Peroxi-Radikale RO2 vorhanden sind. vorhanden sind.
|
|
Schließlich werden die Peroxi-Radikale verbraucht, Ozon wird gebildet und die Stickoxide werden immer wieder recycelt. Dies ist nur möglich, wenn
a) genügend Sonnenlicht für eine effiziente Photolyse vorhanden ist (heiße, sonnige Tage)
b) Wenn die richtige Mischung aus Peroxi-Radikalen und Stickoxiden die Reaktion begünstigt.
|
 |
 |
|
4. Der vollständige Ozon-Oxidations-Zyklus
Bild: Anja Kaiser © ESPERE
|
|
Sind keine Stickoxide vorhanden, so kann der Reaktionszyklus nicht ablaufen.
Sind zu viele Stickoxide vorhanden, so reagiert das überschüssige NO nicht nur mit den Peroxi-Radikalen, sondern verbraucht auch das neu gebildete Ozon.
Ist kein Sonnenlicht vorhanden, so kann NO nicht wiedergewonnen werden und auch die Bildung von Peroxi-Radikalen ist weniger begünstigt.
Gewöhnlich ist die Menge an Stickoxiden in reiner Luft nicht hoch genug für eine ausgeprägte Ozonsmog-Periode. Sind jedoch die Abgasmengen aus Verkehr und anderer menschlicher Aktivität hoch, wie es im städtischen Umfeld der Fall ist, so müssen wir bei entsprechender Wetterlage damit rechnen. Eine vergleichbare Situation kann auch in den Rauchfahnen von Wald- und Steppenbränden auftreten, wenn größere Mengen an Stickoxid in den Flammen gebildet werden.
|
About this page:
author: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz
scientific reviewer: Dr. Rolf von Kuhlmann - MPI for Chemistry, Mainz
educational proofreading: Michael Seesing - Univ. of Duisburg - 2003-07-02
Letzte Überarbeitung: 2008-06-23 | Alle Bilder auf dieser Seite entstanden durch Unterstützung der Chemieverbände Rheinland-Pfalz.
|
|
 |
|







