|
|
 |
|
|
|
 |
| |
|
|
 |
Klima in Städten
Mehr |
Woher kommt saurer Regen?
Saurer Niederschlag ist ein Teil der Deposition (Absetzung, Niederschlagung) von Säure, die nass oder trocken erfolgen kann. Die Bildung von Säuren in der Luft erfolgt durch photochemische Oxidation von Schwefeldioxid (SO2) und Stickoxiden (NOx = NO, NO2). Sie ist jedoch erheblich beeinflusst von der Anwesenheit anderer Substanzen, wie z.B. leichflüchtigen organischen Verbindungen (VOCs).
|
|
|
|
|
 |
Ein genauerer Blick auf den pH
Im Kapitel "Was ist saurer Regen?" (Basis) erklärten wir die pH-Skala. Die Erstellung dieser Skala beruht darauf, dass reines Wasser in Hydroniumionen H3O+ und Hydroxidionen OH- dissoziiert.

Für die Dissoziation gilt das Massenwirkungsgesetz. Die Konstante Kw bezeichnen wir als Ionenprodukt des Wassers und ihr Wert ist immer 10-14.
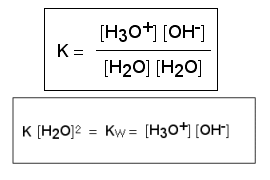
Für jede Säure oder Base in wässriger Lösung gilt somit: pKw = pH + pOH = 14
In reinem Wasser gilt: c(H3O+) = c(OH-) = 10-7 mol/l und pKw = 7 + 7 = 14
Wir sprechen von der Autodissoziation und Autoprotolyse.
|
Entdeckung des Problems: Saurer Regen
Das Phänomen des sauren Regens wurde bereits gegen Ende des 17. Jh. beobachtet. Im Jahr 1692 veröffentlichte Robert Boyle das Buch "Eine allgemeine Geschichte der Luft", in dem er den sauren Regen als "stickstoffartige und salz-schweflige Geister" beschrieb. Der Begriff 'saurer Regen' wurde erstmalig im Jahr 1872 von Robert Angus Smith (1817-1884) benutzt. Der Wissenschaftler aus Manchester schrieb das Buch "Luft und Regen: Der Beginn einer chemischen Klimatologie". Im größeren Maßstab wurde man sich des Problems in den 60er Jahren des letzten Jahrhunderts bewusst. Man fand heraus, dass in den skandinavischen Seen der Säuregehalt stieg und die Fischbestände abnahmen. Ähnliche Vorgänge liefen in Nordamerika ab. In der Folgezeit wurde das Problem von Forschung und Politik sowie in der technischen Entwicklung verstärkt angegangen.
|
Menschliche Emissionen als Quelle des sauren Regens
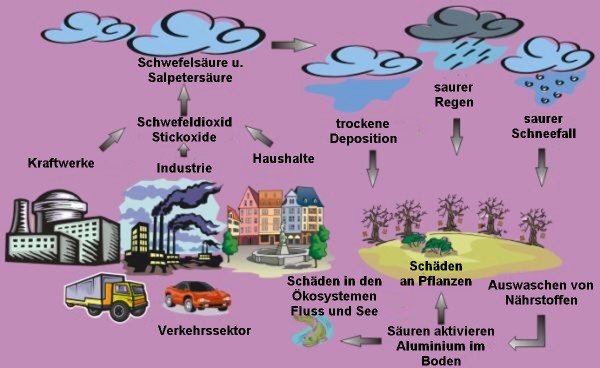
Abgesehen von SO2 und NOx, die bei der Verbrennung fossiler Energieträger freigesetzt werden, tragen auch noch einige andere Substanzen zum sauren Regen bei. Hierzu gehören Salzsäure, Ammoniumsalze und Kohlenwasserstoffe. Wenn gasförmiges Chlorwasserstoffgas HCl sich in Regentropfen löst, entsteht Salzsäure (HCl(aq)). Organische Säuren wie Ameisensäure, Essigsäure oder Oxalsäure werden teilweise direkt von den Pflanzen freigesetzt, teilweise auch in atmosphärischen Oxidationsprozessen aus anderen flüchtigen Kohlenwasserstoffen (VOC) gebildet. Kohlenwasserstoffe beeinflussen auch die Chemie der Stickstoff- und Schwefeloxide. Im städtischen Raum kommen sie überwiegend aus den Abgasen von Verkehr und Industrie. Abseits der dicht besiedelten Gebiete werden sie jedoch in weitaus größeren Mengen natürlich gebildet. Ammoniumverbindungen werden insbesondere in der Landwirtschaft als Dünger eingesetzt und sind Teil des Stickstoffkreislaufes im Boden. Die spezielle Rolle von Ammoniak und Ammoniumverbindungen erklärt der nächste Abschnitt.
|
Die Doppelrolle von Ammoniak
Das Gas Ammoniak (NH3) spielt eine doppelte Rolle in der atmosphärischen Säurechemie. Zum einen neutralisiert es teilweise die Säuren, die durch die Oxidation von Schwefeldioxid und Stickoxiden gebildet werden (Schwefelsäure und Salpetersäure). Es bilden sich die jeweiligen Salze des Ammoniumions (NH4+). Ammoniak selbst ist eine schwache Base. Durch die Reaktion mit starken Säuren entstehen Salze wie (NH4)2SO4 und NH4NO3, die durch das in wässriger Lösung schwach sauer reagierende Ammoniumion immer noch eine gewisse Säurewirkung haben. Im Boden werden sie überdies Bestandteil des Stickstoffkreislaufes. Eine Nitrifizierung erfolgt, die zur zusätzlichen Freisetzung von Säure führt.:
NH4+ + 2 O2 -> 2 H+ + NO3- + H2O
Der Boden versauert durch den Ammoniumeintrag also weiter.
|
 |
 |
|
1. Quellen und Auswirkungen des sauren Regens und anderer Arten der sauren Deposition.
Autor: Sebastian Wypych
|
Deposition
Die Prozesse, in denen chemische Stoffe in der Luft zurück zur Erde geführt werden, sei es durch Absinken oder durch Niederschlag, bezeichnen wir allgemein als Deposition. Im Falle von Niederschlag (Regen, Nebel, Schnee, ...) sprechen wir von nasser Deposition, im Falle von Absinken und Absetzen ohne Niederschlag von trockener Deposition. Handelt es sich bei den Stoffen um Säuren, so bezeichnen wir dies auch als Säuredeposition.
|
Nasse Deposition
Nasse Deposition ist der Prozess, bei dem Chemikalien aus der Atmosphäre entfernt werden und durch Regen, Schnee, Wolkenwasser, Nebel oder Graupel zur Erdoberfläche gelangen. Der saure Regen oder saure Niederschlag ist das Ergebnis vieler chemischer Reaktionen, die sich in der Luft abspielen. Zunächst werden vor allem bei Verbrennungsprozessen Gase wie Schwefeldioxid (SO2), Stickstoffdioxid (NO2) oder Stickstoffmonoxid (NO) in die Atmosphäre entlassen. Sie reagieren mit Hydroxy-Radikalen OH und Sauerstoffatomen O, wodurch Säuren entstehen, vor allem Schwefelsäure (H2SO4) und Salpetersäure (HNO3). Die Säuretröpfchen sind sehr hygroskopisch, d.h. sie werden von Wasser leicht aufgenommen. Daher können sie als Kondensationskeime für die Wolkenbildung dienen. Der saure Regen erreicht schließlich den Erdboden. Zusammen mit anderen Niederschlagsarten kann es auch zu saurem Nebel und saurem Schnee kommen.
|
Trockene Deposition
Obwohl wir für gewöhnlich mit der Bedrohung durch Säure regnerische Tage verbinden, erfolgt die Depositon der Säuren stetig und auch an sonnigen Tagen. Das Absinken und Absetzen saurer Gase und Partikel aus der Atmosphäre bezeichnen wir als (saure) trockene Deposition. Die Säure reagiert dann entweder am Boden mit Feuchtigkeit oder beschädigt Pflanzen, Gebäudeoberflächen usw. Etwa die Hälfte der atmosphärischen Säuren erreichen über trockene Deposition die Erde.
|
|
Trocken abgesetzte Gase und Partikel können von Bäumen und Oberflächen mit dem Regen abgewaschen werden. Geschieht dies, so fügt das ablaufende Wasser die Säuren wieder dem sauren Regen hinzu und verstärkt dadurch seinen Effekt. Trockene Deposition erfolgt vor allem in der Nähe der Emissionsquellen, während nasse Deposition nicht selten 1000 km von der Quelle entfernt erfolgt. Höhere Fabrikschornsteine können Verschmutzungen in die mittlere Troposphäre entlassen. Dies verringert die Konzentration nahe der Oberfläche, erweitert aber die Größe des betroffenen Gebietes. Die mit dem Regen eingetragene Säure verursacht meist größere Probleme als die trockene Deposition, da chemische Reaktionen auf dem längeren Transportweg den Effekt verstärken.
|
About this page:
authors: Anita Bokwa - Jagiellonian University, Cracow, Poland and Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz, Germany
scientific reviewer: Kimitaka Kawamura - Hokkaido University, Sapporo, Japan - 2004-08-12
Educational reviewing: Michael Seesing - University of Duisburg, Duisburg, Germany
Übersetzung 2004 und letzte Überarbeitung 2007-09-11: Elmar Uherek - Max-Planck-Institut für Chemie, Mainz
|
|
 |
|







