|
|
 |
|
|
|
 |
 |
 |
 |
|
Schwefel ist eines der wenigen Elemente, welches wir in der Natur auch in Reinform finden können, z.B. in der Nähe von Vulkanen (links), manchmal sogar in solch schönen Kristallen wie rechts gezeigt.
|
Einführung
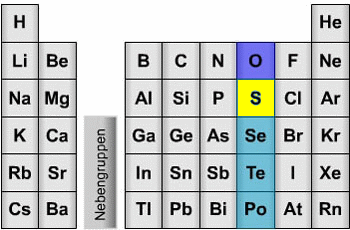
Das Element Schwefel mit dem chemischen Symbol S befindet sich im Periodensystem der Elmente in der 6. Hauptgruppe. Wie erwarten daher eine gewisse Verwandtschaft mit dem darüber stehenden Sauerstoff. Diese Verwandschaft gibt es auch. Ähnliche wie Sauerstoff Metalloxide bildet, findet man Schwefel in Metallsulfiden. Genauso wie Sauerstoff OH-Gruppen bildet, bildet Schwefel SH-Gruppen und in Analogie zum Wasser (H2O) finden wir den allerdings giftigen und gasförmigen Schwefelwasserstoff (H2S), der einen allseits bekannten Geruch nach faulen Eiern verbreitet.
|
Der Schwefel unterscheidet sich in seiner Elektronenkonfiguration darin vom Sauerstoff, dass er durch seine Stellung in der 3. Periode freie d-Orbitale zur Verfügung hat. Dies bedeutet: Schwefel muss sich in seinen Bindungen nicht an die Oktett-Regel halten, sondern kann wie z.B. in der Schwefelsäure sechsbindig sein. Schwefel hat eine größere Elektronenhülle, die ihn in den Bindungen viel 'weicher' macht. Schwefel-Bindungen sind nicht so stark wie Sauerstoff-Bindungen.
Mehr über die anorganischen Eigenschaften von Schwefel finden wir HIER
|
 |
 |
 |
|
Schwefel im Periodensystem der Elemente
|
|
 |
 |
|
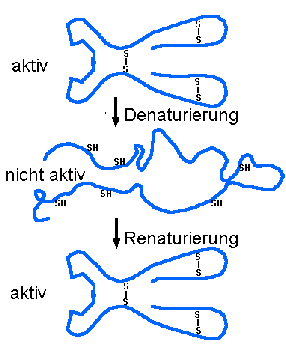
Schwefelbrücken geben Proteinen die Form und ermöglichen die Funktion von Enzymen.
|
|
 |
Dadurch, dass die Bindungen leichter zu bilden und wieder zu lösen sind, kommt Schwefel in der Biologie eine ganz besondere Rolle zu. In vielen Fällen, in denen relative schwache sich verändernde Bindungen gebraucht werden, ist Schwefel im Spiel. So zum Beispiel bei der Bildung der Form von Proteinen durch S-S Brückenbindungen. Die Enzyme, die unendlich viele Prozesse in unserem Körper gezielt steuern, könnten ohne Schwefel nicht arbeiten. Das Bild zeigt, wie Schwefelbindungen dafür sorgen, dass Proteine aktiv oder inaktiv sein können. Solche Schwefelbrücken nutzt man auch in der Industrie, z.B. beim Herstellen von GUMMI.
Schwefel gehört somit zu den sechs ganz wichtigen Elementen in organischen Verbindungen: P. C O H N S (leicht zu merken als Paulchen Cohns). Phosphor, Kohlenstoff, Sauerstoff, Wasserstoff, Stickstoff, Schwefel.
|
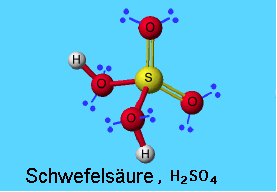
Schwefel spielt aber auch eine große Rolle in seinen anorganischen Verbindungen. Schwefeldioxid ist (in größeren Mengen) ein Luftschadstoff. Schwefelsäure ist eine der wichtigsten Säuren überhaupt. Das Säureanion, Sulfat, bildet mit Metallen so bekannte Verbindungen wie Calciumsulfat (= Gips).
In unserer natürlichen wie auch vom Menschen beeinflussten Umwelt finden wir Schwefel sowohl in anorganischen als auch in organischen Verbindungen. Die verschiedenen Formen können ineinander umgewandelt werden. Wir sprechen von einem Schwefelkreislauf.
|
 |
 |
 |
|
Schwefelsäure ist konzentriert und flüssig eine sehr gefährliche stark ätzende Säure. In Spuren finden wir sie aber auch in der Luft, wo sie eine wichtige Rolle bei der Wolkenbildung spielt. Mehr zu Schwefelsäure.
|
|
|
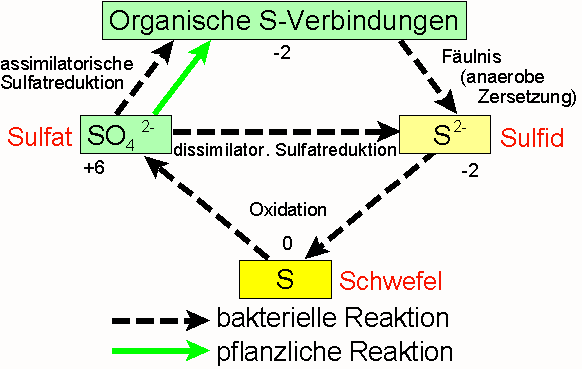
An den Umwandlungen im natürlichen Schwefelkreislauf, wie er unten vereinfacht gezeigt ist, sind vor allem Bakterien beteiligt. Auf der Hauptseite haben wir aber in einem erweiterten Schwefelkreislauf gesehen, dass der Schwefel auch eine große Bedeutung in unserem Klimasytem hat. Hierbei spielen anorganische Reaktionen in der Luft eine Rolle. In diesem Projekt zum Schwefelkreislauf und der klimatischen Bedeutung von Schwefel zeigen wir, wo überall in unserer Umwelt das Element und seine Verbindungen auftreten und wie sie unsere Umwelt beeinflussen.
|
 |
 |
|
Vereinfachter Schwefelkreislauf nach KINDL.
Text: Elmar Uherek
|
|
 |
|







