> Deutsch > Climate Encyclopaedia > Untere Atmosphäre > Basis > 3. Ozon > - Stickoxide
> Deutsch > Climate Encyclopaedia > Untere Atmosphäre > Basis > 3. Ozon > - Stickoxide
|
Untere AtmosphäreBasis |
Stickoxide - Bildung und BedeutungStickoxide spielen eine wichtige Rolle in atmosphärischen Prozessen. Wie werden sie gebildet? Warum sind sie wichtig?
|
 |
|
|
1. Straßenverkehr - immer noch eine Hauptquelle von Stickoxiden.
|
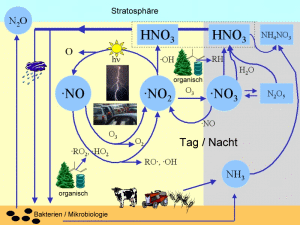
Woher kommen Stickoxide?Die wichtigsten Stickoxide sind Stickstoffmonoxid NO und Stickstoffdioxid NO2. Beide zusammen werden als NOx bezeichnet. Die Stickstoffmoleküle der Luft (N2) sind sehr stabil und es ist nicht einfach, sie zu oxidieren. Einige Bakterien haben spezielle Mechanismen entwickelt, die N-N Dreifachbindung zu knacken und oxidierte Verbindungen zu bilden. Aber weit wichtiger sind Prozesse, in denen die Bindung durch Hitze gebrochen wird. Dies ist nur unter extremen Bedingungen möglich. Ein Beispiel ist die Verbrennung von Treibstoff in einem Automotor. Der Hauptteil des vom Menschen erzeugten NOx stammt aus dieser Quelle. Aber auch andere sehr heiße Reaktionen können die Ursache sein, z.B. die heißesten Teile der Flammen bei Waldbränden. Auch Blitze sind eine bedeutende Quelle. Im Kanal eines Blitzes können Temperaturen von bis zu 30.000 °C erreicht werden und mit Leichtigkeit Stickstoffbindungen aufgebrochen werden. 2. rechts: Blitze sind eine weitere wichtige Quelle von Stickoxiden.
|
|
|
Die Säure ist der Hauptweg, wie Stickoxide wieder aus der Atmosphäre entfernt werden, entweder durch trockenes Absetzen an Oberflächen (trockene Deposition) oder durch Auswaschung durch Regen (feuchte Deposition). Salpetersäure finden wir auch in den polaren Stratosphärenwolken. Hier bildet sie mit Wasser Eispartikel, an denen sich das Ozonloch bildet (siehe: Obere Atmosphäre - Mehr - Einheit 2).
|
|
Namen von Stickstoffverbindungen:
|
|
Stickstoffoxide sind als Gase sehr wichtig für die Bildung und den Abbau von troposphärischem, d.h. bodennahem Ozon, denn sie sind in viele atmosphärische Kreisläufe verwickelt. Sie dienen als Katalysatoren, als Stoffe, die wieder unverändert aus einem Reaktionskreislauf hervorgehen. Hierbei wird NO2 durch das Sonnenlicht gespalten, bildet NO und NO wird wieder zu NO2 oxidiert. Sowohl Ozon als auch organische instabile hoch oxidierte Verbindungen, sogenannte Peroxide, können die Oxidation antreiben. Details erklärt der nächste Text. Distickstoffmonoxid N2O, besser bekannt als Lachgas, wird in mikrobiologischen Abbauprozessen durch Bakterien gebildet. Es reagiert in der Troposphäre nicht, sondern wandert langsam hoch in die Stratosphäre. Hier wird es durch Licht gespalten.
|
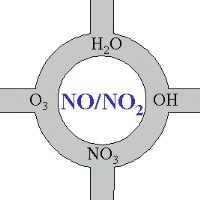
Stickoxide als Knotenpunkte atmosphärischer ChemieAuch wenn wir die Chemie der Stickstoffoxide nicht im Detail betrachtet haben, so können wir uns doch merken, dass diese Verbindungen in gewisser Weise das Herz der Atmosphärenchemie sind. Ein großer Teil derjenigen chemischen Verbindungen, die oxidiert und aus der Atmosphäre entfernt werden oder in andere Verbindungen umgewandelt werden, kommen hierbei direkt oder indirekt mit der Chemie von NO oder NO2 in Berührung.
|
|
|
|