|
|
 |
|
|
|
 |
| |
|
|
 |
Obere Atmosphäre
Mehr .. |
Chlorchemie
Vor allem die Chlorchemie treibt die Zerstörung der Ozonschicht an. Mit der industriellen Produktion der Fluorchlorkohlenwasserstoffe (FCKW) brachte der Mensch eine völlig neue Spezies von Chlorverbindungen in die Atmosphäre. Chlorverbindungen sind heute um das Sechsfache höher konzentriert als von Natur aus, mit fatalen Folgen für die Ozonschicht. Die Bedingungen für die Bildung des Ozonloches über der Antarktis allerdings sind ganz besondere. Von daher wurde auch eine so drastische Entwicklung nicht vorhergesehen.
|
|
|
|
|
 |
 |
 |
|
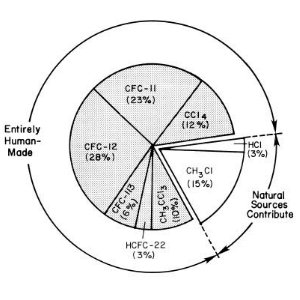
1. Primärquellen des Chlors, das in die Stratosphäre eintritt, in den frühen 90er Jahren.
Quelle: UNEP/WMO Scientific Assessment of Ozone Depletion
Bitte das Bild zum Vergrößern anklicken!
|
|
 |
FCKW - Gase ohne natürliche Quelle
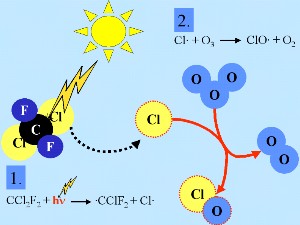
Die Ozon zerstörenden Gase mit dem stärksten Einfluss auf das Klima sind CFC-11 (CFCl3), CFC-12 (CF2Cl2), und CFC-113 (CF2ClCFCl2). Aus Messungen von Lufteinschlüssen im polaren Eis wissen wir heute, dass es für diese Verbindungen keine natürlichen Quellen gibt. Die einzig relevante natürliche Quelle für Chlor ist Methylchlorid (CH3Cl) und diese Verbindung hat eine vergleichsweise geringe Lebensdauer von 1,3 Jahren. Aufgrund ihrer Stabilität gegenüber OH Radikalen und Photolyse in der Troposphäre haben FCKW eine hohe troposphärische Lebensdauer von ca. 50-100 Jahren. Sie erreichen die Stratosphäre und werden dort photolysiert, was zu einer Bildung von Chlorradikalen führt. Allein die Anwesenheit dieser Radikale muss nicht zu einem drastischen Ozonabbau führen, da andere Abbaureaktionen konkurrieren. Besondere Bedingungen führen zu einer besonders starken Ozonreduktion, wie die folgenden Abschnitte zeigen.
|
|
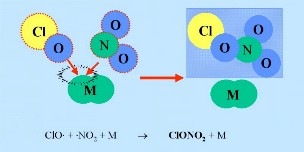
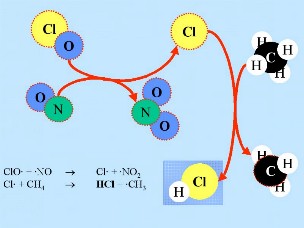
ClO + +  NO2 + M* NO2 + M* |
-> ClONO2 + M* |
|
und |
|
|
ClO + +  NO NO |
-> Cl + +  NO2 NO2 |
|
Cl + CH4 + CH4 |
-> HCl + CH3 |
HCl und ClONO2 sind sogenannte 'Reservoir Spezies', da in ihnen Chlor nicht aktiv ist sondern zwischengelagert. Solche Spezies reagieren nicht mit Ozon. Sie verbleiben normalerweise in der Gasphase und können nach und nach wieder aus der Stratosphäre entfernt werden. Daher ist in der normalen stratosphärischen Gasphasenchemie nur ein leichter Ozonabbau zu erwarten. Doch werden diese Spezies mit der allgemeinen Zirkulation in die untere Stratosphäre der Gebiete im polaren Winter transportiert ...
|
 |
 |
 |
|
2. c) Grundlagen der stratosphärischen Chlorchemie
|
|
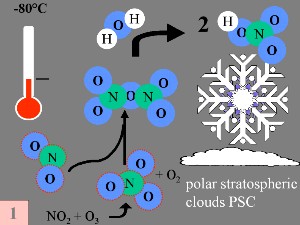
Die speziellen Bedingungen des Ozonloches über der Antarktis
Während der Polarnacht mit Temperaturen von etwa -80°C beginnen selbst die letzten Spuren von Wasser, die in der Stratosphäre verfügbar sind, zu gefrieren. Sie bilden zusammen mit Salpetersäure polare stratosphärische Eiswolken (sogenanntes Salpetersäuretrihydrat -> nitric acid trihydrate NAT). Nun können fünf Schlüsselbedingungen zusammenkommen.
|
 |
 |
|
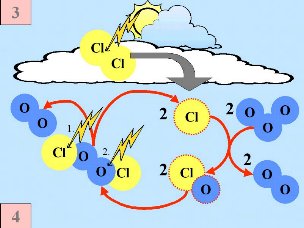
3. a) Besondere Bedingungen und Ozonchemie während der Ozonlochbildung.
Abbildungen: Elmar Uherek; Vollgröße: 50-100 KB
|
|
 |
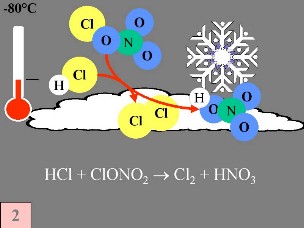
Erstens: Die Stickoxidkatalysatoren (Stickstoffmonoxid NO und Stickstoffdioxid NO2), die dabei helfen, ClO in HCl zu überführen, werden durch die folgenden Reaktionen der Stratosphärischen Gasphase entzogen: in HCl zu überführen, werden durch die folgenden Reaktionen der Stratosphärischen Gasphase entzogen:
 NO + O3 NO + O3 |
->  NO2 + O2 NO2 + O2 |
 NO2 + NO2 +  NO3 + M* NO3 + M* |
-> N2O5 + M |
| N2O5 + H2O |
-> 2 HNO3 |
Die hierbei erzeugte Salpetersäure HNO3 wird in die Eisteilchen der polaren Stratosphärenwolken (polar stratospheric clouds PSC) eingeschlossen.
|
 |
 |
|
3. b) Besondere Bedingungen und Ozonchemie während der Ozonlochbildung
|
|
 |
Zweitens: Auf der Oberfläche der PSC bildenden Eispartikel reagieren die 'Reservoir Spezies' HCl und ClONO2 miteinander und erzeugen Cl2 und HNO3; letztere wird sofort in die Partikel eingebaut.
Drittens: Nach Ende der Polarnacht und der Rückkehr des Tageslichtes wird Chlor Cl2 durch das Sonnenlicht gespalten (photolysiert) und erzeugt 2 Cl Radikale. Chlor wird wieder aktiv. Radikale. Chlor wird wieder aktiv.
|
 |
 |
|
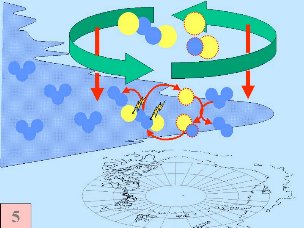
3. d) Besondere Bedingungen und Ozonchemie während der Ozonlochbildung
|
|
 |
Fünftens: Normalerweise werden Chlorspezies wie Cl , ClO , ClO und Cl2O2 eher in der oberen Stratosphäre gebildet, während Ozon in der unteren Stratosphäre konzentriert ist. Vor einigen Jahrzehnten gingen daher die Forscher nicht davon aus, dass Ozon stark reduziert werden könnte. Ozon und Ozon abbauende Substanzen sollten nur in Grenzbereichen zusammenkommen. An diesem Punkt jedoch kam der Polarwirbel (polar vortex) ins Spiel. Die Chlorspezies werden in diesem Wirbel von der mittleren und oberen Stratosphäre nach unten gesogen. So erreichen sie diejenigen Regionen, in denen die höchsten Ozonkonzentrationen vorliegen. und Cl2O2 eher in der oberen Stratosphäre gebildet, während Ozon in der unteren Stratosphäre konzentriert ist. Vor einigen Jahrzehnten gingen daher die Forscher nicht davon aus, dass Ozon stark reduziert werden könnte. Ozon und Ozon abbauende Substanzen sollten nur in Grenzbereichen zusammenkommen. An diesem Punkt jedoch kam der Polarwirbel (polar vortex) ins Spiel. Die Chlorspezies werden in diesem Wirbel von der mittleren und oberen Stratosphäre nach unten gesogen. So erreichen sie diejenigen Regionen, in denen die höchsten Ozonkonzentrationen vorliegen.
|
Alle fünf Bedingungen müssen zusammenkommen, um einen sehr starken Ozonabbau wie im Ozonloch zu bewirken. Daher erfolgt der gravierendste Abbau über der Antarktis und ausschließlich in den Monaten September / Oktober des antarktischen Frühlings am Ende der Polarnacht. In manchen Jahren stellen sich ähnliche Bedingungen auch im März über der Arktis ein und ein kleineres Ozonloch bildet sich über Nordeuropa. Später im Jahr lösen sich die Polarwolken auf, Stickoxide werden wieder verfügbar und der Polarwirbel bricht zusammen. Dann werden die Chlorradikale anderweitig abgefangen und die Ozonschicht erholt sich wieder.
|
 |
 |
 |
|
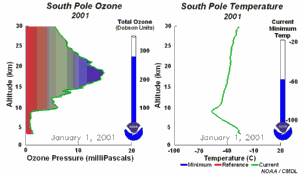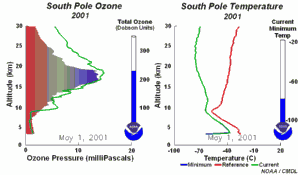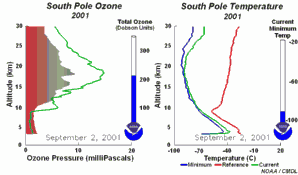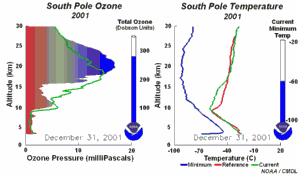
4. Die Entwicklung des Ozonlochs im Jahr 2001
Bitte das Bild anklicken für eine vergrößerte Zeitserie mit 5tägiger Auflösung (270 K)!
Die Original-Animation stammt vom NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado,  http://www.cmdl.noaa.gov . http://www.cmdl.noaa.gov .
|
|
______________
*M: In jeder Reaktion vom Typ A + B -> C wird ein dritter Partner benötigt, der Energie aus der Reaktion übernimmt. Wäre dies nicht so, so hätte das Produkt C nach der Reaktion denselben Energieinhalt wie die Edukte A + B und könnte sofort zurückreagieren. In den meisten Fällen ist der Stoßpartner M der Stickstoff aus der Luft N2.
|
About this page:
author: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz
scientific reviewer: Dr. Christoph Brühl, MPI Chemistry, Mainz
educational proofreading: Michael Seesing - Uni Duisburg - 2003-08-07
Letzte Überarbeitung: 2007-08-23 |
|
|
 |
|