> Deutsch > Climate Encyclopaedia > Untere Atmosphäre > Mehr > 3. Ozon & Feuer > - Feuer
> Deutsch > Climate Encyclopaedia > Untere Atmosphäre > Mehr > 3. Ozon & Feuer > - Feuer
|
Untere AtmosphäreMehr .. |
Feuer - ihre Chemie und globale BedeutungJedes Jahr brennen riesige Flächen auf unserem Planeten: 10 Mio Hektar borealer Wälder in den nördlichen Breiten (z.B. Nadelwälder in Sibirien) 1 Mio Hektar(ha) = 1 Mio x 100 m x 100 m = 10.000 km2 Stelle dir die Fläche vor:
|
|
| |||||||
|
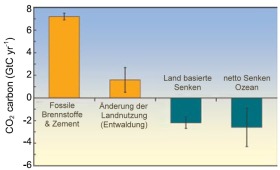
Das weltweite Kohlenstoff-Budget für den CO2-Austausch Emissionen aus vom Menschen verursachten Feuern, die oft mit einer Veränderung der Landnutzung verbunden sind, sind eine wichtige Quelle für CO2. |
 |
|
3. Kohlendioxid - Quellen und Senken - Bild: Elmar Uherek
|
|
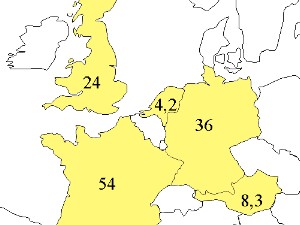
Die Hauptquellen sind
|
Die Hauptsenken sind:
|
|
Natürliche Vegetationsfeuer können kurzfristig eine Quelle von CO2 sein, aber langfristig gleicht sich dies aus oder sie bilden sogar eine sehr geringe Senke (< 0,1 Pg C / Jahr), denn Kohlenstoffsedimente werden im Boden abgelagert. Offene Wälder und Savannen brennen in einem Zyklus von 1-3 Jahren auf weit größeren Flächen als die Regenwälder, aber ohne große Störungen für unser Klimasystem. Denn was hier verbrennt, wächst wieder nach. |
 |
|
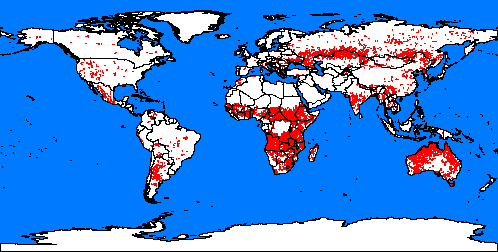
4. Brandherde rund um die Welt:
|
Was entsteht während des Verbrennungsprozesses?Dies hängt davon ab Woraus bestehen Pflanzen?Der Wassergehalt von Pflanzen kann bei bis zu 60% liegen. Gewöhnlich aber geht der 'Feuersaison' eine Trockenzeit voraus, in der die Pflanzen viel Wasser verlieren. Die typische Zusammensetzung des trockenen Materials ist: in Elementen:
in Substanzen:
|
|
|
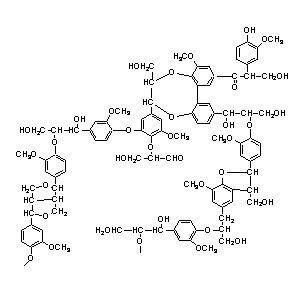
Lignin entsteht dadurch, dass Zuckern irreversibel Wasser entzogen wird, wobei sich aromatische Ringstrukturen bilden. Die OH-Gruppen können miteinander unter Bildung von Aldehyden und Ketonen reagieren. Das Ergebnis ist eine Polymerstruktur mit Etherbindungen. Der VerbrennungsprozessNachdem sich ein Brand entzündet hat, gibt es gewöhnlich eine Periode offenen Feuers, sofern genug Sauerstoff vorhanden ist. Dem folgt eine Periode von Schwelbränden, während der nicht genug Sauerstoff vorhanden ist.
|
|
| |||||||
|
Nachdem sich ein Feuer entzündet hat (> 180°C / 450 K), findet eine lodernde Verbrennung (> 580°C / 850 K) statt: Einfache Moleküle wie CO2, H2O, NO, N2O, N2 und SO2 werden als Oxidationsprodukte freigesetzt. Danach erlöschen die Flammen langsam ...
|
... und ein Stadium glimmenden Schwelbrands (< 580°C / 850 K) beginnt. Da es an Sauerstoff mangelt, werden CO und viele nur teilweise oxidierte organische Verbindungen wie Formaldehyd, Acetaldehyd, Methanol, Aceton, Methan usw. freigesetzt.
|
Verwandte Seiten:Weitere Informationen zu Feuern und den freigesetzten Gasen finden sich unter:
|
scientific reviewer: Dr. Rolf Sander - MPI for Chemistry, Mainz 2004-05-18 Letzte Überarbeitung: 2007-08-22 |