|
|
 |
|
|
|
 |
| |
|
|
 |
Baixa Atmosfera
Ler mais |
Técnicas de medição - espectroscopia
A maior parte dos gases vestigiais na atmosfera existem em concentrações de menos de uma parte num milhão. Como podemos saber exactamente a sua concentração? Que técnicas de medição são normalmente utilizadas?
|
|
|
|
|
 |
|
Para a análise do ar, tanto no laboratório ou directamente no exterior, duas técnicas são usadas muito frequentemente:
a) espectroscopia - baseada em diferentes interacções das moléculas com a luz
b) cromatografia - baseada em diferentes interacções das moléculas com outras moléculas |
 |
 |
|
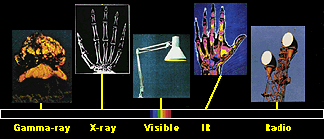
1. O espectro electromagnético consiste de diferentes tipos de ondas electromagnéticas com diferentes energias. A maior parte delas são muito úteis para investigar a atmosfera, o carácter e a concentração de moléculas de ar.
fonte e mais informação acerca do espectro electromagnético:  NASA NASA
|
|
 |
O carácter da radiação
Da experiência da nossa vida com rádios, microondas, salões de bronzeamento e exames de raio-X nós sabemos, que existem muitas ondas electromagnéticas no ar, todas com diferentes energias e apenas algumas são visíveis como a luz. Todas as juntas formam o espectro electromagnético. A energia de tais ondas aumentam na seguinte ordem ondas rádio, microondas, radiação infravermelha, radiação visível, radiação ultravioleta, raios-X. Quanto menor é o comprimento de onda, maior é a frequência, maior e a energia. Praticamente todas estas ondas interagem com moléculas dear e pela maneira como o fazem, nós podemos ver o que molécula causou esta interacção.
|
|
Comprimento de onda, frequência e energia de diferentes regiões do espectro electromagnético:
|
|
Compri. de onda (m) |
Frequência (Hz = s-1) |
Energia (J) |
|
Rádio |
> 1 x 10-1 |
< 3 x 109 |
< 2 x 10-24 |
|
Microondas |
1 x 10-3 - 1 x 10-1 |
3 x 109 - 3 x 1011 |
2 x 10-24- 2 x 10-22 |
|
Infravermelho |
7 x 10-7 - 1 x 10-3 |
3 x 1011 - 4 x 1014 |
2 x 10-22 - 3 x 10-19 |
|
Visível |
4 x 10-7 - 7 x 10-7 |
4 x 1014 - 7.5 x 1014 |
3 x 10-19 - 5 x 10-19 |
|
UV |
1 x 10-8 - 4 x 10-7 |
7.5 x 1014 - 3 x 1016 |
5 x 10-19 - 2 x 10-17 |
|
Raios-X |
1 x 10-11 - 1 x 10-8 |
3 x 1016 - 3 x 1019 |
2 x 10-17 - 2 x 10-14 |
|
Raios-Gamma |
< 1 x 10-11 |
> 3 x 1019 |
> 2 x 10-14 |
|
Interacção da luz e as moléculas
Se uma onda encontra uma molécula de ar, poderá transferir a sua energia para a molécula e alterar o estado da molécula. Para fazer uma molécula rodar necessita menos energia que fazer as ligações oscilarem e ainda mais energia é necessária para transferir electrões para outra órbita do núcleo atómico. Tudo isto depende dos átomos da molécula, o seu tamanho e força das suas ligações. Certas moléculas consomem fracções do espectro electromagnético, para determinadas alterações do seu estado. Consequentemente, se nós emitirmos a radiação através do ar e compararmos a radiação antes e atrás da parcela de ar, nós vemos que determinadas fracções da radiação foram absorvidas (consumida) pelas moléculas, e do carácter da absorção podemos concluir no carácter e da concentração das moléculas. |
|
|
 |
Vamos assumir que emitimos de uma fonte de luz infravermelha (S) de energia diferente (E) o feixe de luz passa através da parcela de ar e medimos a fracção da luz que chega ao detector (D). As energias diferentes (= diferentes comprimentos de onda) são mostradas em diferentes cores avermelhadas.
|
|
|
 |
Uma certa molécula absorve luz de determinada energia (duas de seis energias diferentes são bloqueadas) e esta luz não chega ao detector. Se subtraírmos o espectro original sem a molécula daquele com a molécula, um pico de absorção aparece, que é mostrado à direita. Este pico representa a perda de luz e portanto quanto mais luz é absorvida, maior se torna o pico (ver a figura 2d).
|
 |
 |
|
2. a-c) Animações por Elmar Uherek
Prima para aumentar! (30 Kb)
|
|
 |
Outra molécula absorve luz, também. Mas mais energia é necessária para fazer as ligações oscilarem. O pico de absorção aparece noutra energia (comprimento de onda) do espectro.
|
 |
 |
|
2. d) Em contraste com as três imagens anteriores, aumentamos agora numa gama de energias mais pequena (todas as setas possuem a mesma cor = aproximadamente a mesma energia), exemplo a energia de absorção da primeira molécula. As cores ficam mais fracas no detector dizem-nos, que a luz que chega é menor, assim que temos mais moléculas. A altura da banda de absorção (é uma banda negativa, diz-nos, que MENOS luz chega ao detector) cresce.
|
|
 |
A partir do espectro podemos não só obter a informação de quais moléculas estão no ar (posição da banda de absorção). A partir da intensidade da banda de absorção, podemos também obter informação da quantidade de moléculas existentes no ar, porque a retenção da luz é proporcional ao número de moléculas.
|
Na atmosfera existem diversas possibilidades para medir a absorção da luz. Na Terra a absorção da luz a partir do Sol ou da Lua pode ser medida (gama UV-VIS). Os satélites medem a luz infravermelha emitida a partir da Terra. Podem também medir a radiação solart, que é reflectida pela Terra ou nas nuvens ou o que passa na tangente à superfície da Terra.
|
 |
 |
 |
|
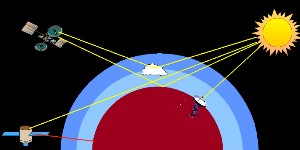
3. Medições da absorção da atmosfera através de satélites
imagem por Elmar Uherek
|
|
Hoje em dia a radiação infravermelha da Terra (temperatura da superfície) é medida por satélites. Mas também muitos compostos inorgânicos importantes como o ozono, óxidos de azoto óxidos de hidrogénio podem ser observados a partir do espaço. Um exemplo para tais medições é o Experiência Global de Monitorização do Ozono (Global Ozone Monotoring Experiment - GOME). Não é só o ozono que é medido mas também o NO2, água, SO2 e formaldaído (HCHO). O instrumento GOME está a bordo do satélite ERS-2 e obtem o espectro na gama de UV-VIS e infravermelho próximo (240-790 nm).
|
 |
 |
 |
|
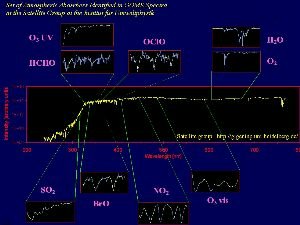
4. Espectros obtidos por satélite de vários compostos inorgânicos na atmosfera, a partir do instrumento GOME.
Fonte: Satellite group IUP Heidelberg
Prima para aumentar! (150 KB)
|
|
 |
 |
|
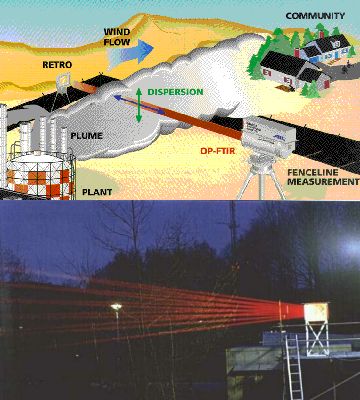
5. a+b) Por favor note: A luz infravermelha não é visível. Aqui os feixes de luz apenas podem ser vistos, porque a fonte de luz emite também uma parte da parte vermelha do espectro visível.
|
|
 |
Certamente a fonte clara e o detector podem também ser instalados ambos sobre a superfície da terra. Uma vez que não podem estar demasiado distantes um do outro e como as concentrações são muito pequenas, um sistema óptico complicado de espelhos é usado (exemplo a também chamada célula branca) de forma a reflectir o feixe várias vezes e para alongar o comprimento do caminho percorrido pela luz através da atmosfera. Na parte esquerda da imagem mostra a instalação em teoria (imagem do EPA Field Analytik Technology Enyclopaedia) e na prática (fotografia de FZ Jülich). Aqui a espectroscopia de infravermelho é usada e um exemplo simples do espectro é dado abaixo.
|
 |
 |
|
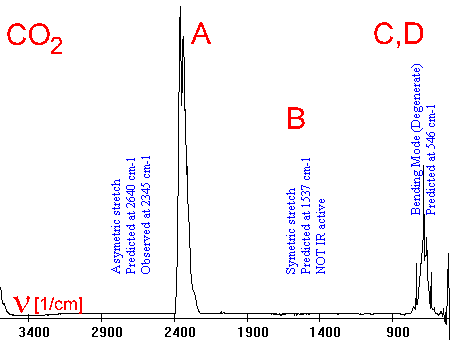
6. Como um simples exemplo do espectro infravermelho do CO2 é dado conjuntamente com as vibrações activadas. O espectro IR pode ser bastante complicado se existe a sobreposição das absorções de diferentes moléculas ou as moléculas são elas mesmo complicadas e muitas vibrações são possíveis (ver o exemplo das vibrações do CO2 na direita).
Espectros e animações a partir de: Scott Van Bramer,  Widener University Widener University
|
|
 |
Vibrações:
A Estiramento assimétrico

B Estiramento simétrico
[IR não activo]

C Curvatura vertical

D Curvatura horizontal

|
About this page:
author: Dr. Elmar Uherek - MPI for Chemistry, Mainz
scientific reviewer: Dr. Mark Lawrence - MPI for Chemistry, Mainz - 2004-05-05
educational proofreading: Michael Seesing - Univ. of Duisburg - 2003-07-02
revised and last published: 2004-05-10
|
|
 |
|







