|
|
 |
|
|
|
 |
| |
|
|
 |
Klima in Städten
Basis |
Was ist saurer Regen?
Wasser ist notwendig für alles Leben auf der Erde. Wird es verschmutzt, so betrifft dies die gesamte Umwelt. Die wichtigste Ursache des sauren Regens sind Emissionen, die bei der Verbrennung fossiler Energieträger (Kohle, Öl, Treibstoff, ...) entstehen. Wie sauer der Regen ist, messen wir mit der sogenannten pH-Skala.
|
|
|
|
|
 |
|
Atmosphärischer Niederschlag (Regen, Niesel, Schnee etc.) fließt teilweise in die Flüsse ab, dringt in den Boden ein und verdampft wieder als Wasserdampf. Einer der Faktoren, der die Güte des Wassers beschreibt, ist der pH-Wert.
|
 |
 |
|
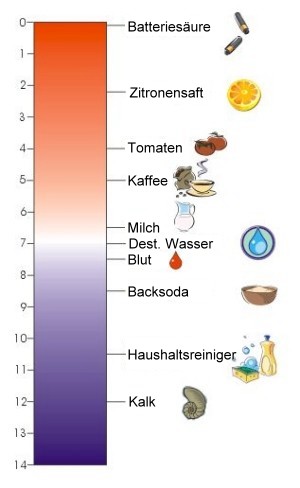
1. Die pH-Skala. Typische pH Werte einiger Nahrungsmittel und im Haushalt verwandter wässriger Lösungen. Je niedriger der Wert, desto saurer die Flüssigkeit.
Autor: Sebastian Wypych
|
|
 |
Die pH Skala
In der Natur finden wir viele chemische Verbindungen, die im Wasser gelöst sind. Manche dieser Verbindungen sind Säuren, die in wässriger Lösung den pH-Wert bestimmen. Je saurer das Wasser ist, desto niedriger ist sein pH. Chemisch gesehen ist der pH-Wert ein Maß für die positiv geladenen Wasserstoffionen, die in wässriger Lösung direkt mit Wasser verbunden sind: H3O+ (Hydronium-Ionen), Die Protonen H+ werden von den Säuren an das Wasser abgegeben. pH ist der negative Zehner-Logarithmus der Hydronium-Ionen Konzentration in Mol pro Liter (mol/l).
pH = -log10[H3O+]
Dies bedeutet, wenn c(H3O+) = 10-7 mol/l, dann ist der pH 7, wenn c(H3O+) = 10-6 mol/l, dann ist der pH 6 usw. Wir sehen, dass mit einem Ansteigen der Ionenkonzentration um Faktor 10 der pH um 1 sinkt.
Die Skala wurde von dem dänischen Wissenschaftler Soren Sorenson im Jahr 1909 eingeführt. Sie reicht von 0 bis 14, wobei ein Wert von 7 als neutral eingestuft wird. Werte größer als 7 sind basisch, Werte kleiner 7 sauer. Einige Beispiele: Essig hat einen pH von 2,5 - 3, destilliertes Wasser einen von 7,0. Konzentrierte Lösungen von Backsoda (NaHCO3(aq)) haben einen pH von 8,2 und einige stark alkalische Haushaltsreiniger auf der Basis von Ammoniumhydroxid (NH4OH(aq)) einen pH von 11-12.
|
|
In reinem Wasser ist die einzige Quelle von Hydroniumionen die Selbstdissoziation der Wassermoleküle, die aber nur in sehr geringem Maße erfolgt. Der chemische Fachbegriff hierfür ist Autoprotolyse.
2 H2O 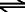 H3O+ + OH- H3O+ + OH-
Die in beide Richtungen weisenden Reaktionspfeile sagen uns, dass die Reaktion reversibel ist. Säure sind chemische Stoffe, die die Konzentration der H3O+ Ionen erhöhen, wenn sie einer Lösung zugegeben werden. Je höher c(H3O+) ist, desto stärker die Säure und desto niedriger der pH.
Saurer Regen
Niederschlag ist für gewöhnlich leicht sauer, da sich das natürlich in der Luft vorkommende Kohlendioxid (CO2) in ihm löst. Eine wässrige Lösung von Kohlendioxid kennen wir als Kohlensäure (H2CO3) z.B. in Mineralwasser. Hierdurch hat der Regen einen pH-Wert von ca. 5,6. Kohlensäure ist in wässriger Lösung nicht stabil sondern dissoziiert in die Ionen, H3O+ und Hydrogencarbonat HCO3-.
|
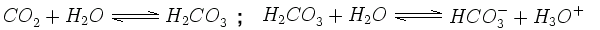 |
 |
|
In starker alkalischer Umgebung kann die Kohlensäure ein weiteres Hydroniumion verlieren und es entsteht Carbonat. Viele Gebirge und Sedimente, z.B. Dolomit und andere Kalksteine, sind aus Carbonatsalzen aufgebaut.
|
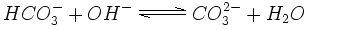 |
 |
|
|
|
Da schon sauberer Regen einen pH-Wert von 5,6 hat, sprechen wir von saurem Regen bei einem pH unter 5,6. Manche Wissenschaftler wählen auch pH < 5,0 als Schwelle. Natürlich muss sich die Säurebelastung nicht nur auf Regen beschränken. Genauso kann Schnee oder Nebel sauer sein, sodass wir allgemein von saurem Niederschlag sprechen. Der menschliche Beitrag zur Säure des Regens kommt von Stickstoff und Schwefelverbindungen. SO2 und NOx durchlaufen mehrere komplexe Schritte bis sie zu Schwefelsäure (H2SO4) und Salpetersäure (HNO3) werden, die wir im sauren Regen finden.
|
 |
Schwefelsäure hat ihren Ursprung in Schwefelverbindungen:
Schwefeldioxid und Sauerstoff reagieren zu Schwefeltrioxid:
2SO2 +O2 -> 2SO3
Schwefeltrioxid und Wasser reagieren zu Schwefelsäure:
SO3 + H2O -> H2SO4
Salpetersäure entsteht aus Stickoxiden:
Stickstoffdioxid und Wasser reagieren zu Salpetersäure und salpetriger Säure:
2NO2 + H2O -> HNO3 + HNO2
|
|
Der pH einer sauren Wolken kann bis zu 2,6 reichen. Saurer Regen in stark industrialisierten Regionen weist pH-Werte von etwa 4 auf. Nebel in Los Angeles erreichte Werte von weniger als 3. In einigen Teilen der Welt, z.B. im nördlichen Australien, können auch natürliche Emissionen der Vegetation den pH auf Werte um 4,4 sinken lassen.
|
Ursache: Emissionen von SO2 und NOx
Was macht den Regen sauer? Atmosphärische Säuren werden in der Luft vor allem aus chemischen Reaktionen erzeugt, die Verläufer-Gase (SO2 und Stickoxide) mit Wasser eingehen. Das meiste SO2 und NOx wird aus Verbrennungsprozessen emittiert. Der Straßenverkehr, die Schifffahrt und Flugzeuge sind wichtige Quellen von Stickoxiden NOx. Natürliche Quellen sind Vulkane, Blitze und der biologische Abbau pflanzlichen Materials. Natürliche Quellen von SO2 sind ebenfalls Vulkane, die Ozeane (Dimethylsulfid und COS) sowie biologischer Abbau und Waldbrände.
|
 |
 |
 |
|
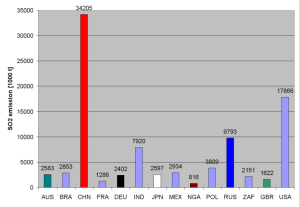
2. Emissionen an SO2 im Jahr 2000 für die Staaten:
Australien, Brasilien, China, Frankreich
Deutschland, Indien, Japan, Mexiko
Nigeria, Polen, Russland, Südafrika
Großbritannien, USA
Daten: World Resources Institute, http://earthtrends.wri.org
|
|
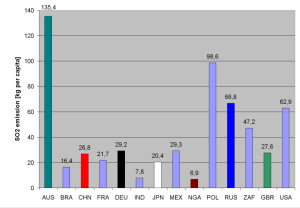
Trotz der natürlichen Vorkommen der Gase hat der saure Regen vor allem in der konzentrierten menschlichen Emission seine Ursache. Die Abbildungen zeigen große Emittenten von SO2 unter den Staaten der Welt. Die USA, China, Russland und Indien tragen große Mengen bei, vor allem auf Grund der großen Bevölkerung. In den USA und Russland ist jedoch auch der Ausstoß pro Kopf hoch. China überschreitet inzwischen auf Grund unzureichender Filtertechnik auch pro Kopf westeuropäisches Niveau.
|
 |
 |
 |
|
2. b) Emissionen an Schwefeldioxid pro Kopf und Jahr in kg.
Daten: World Resources Institute, Grafiken: Elmar Uherek
|
|
Unsicherheiten in den globalen Emissionen
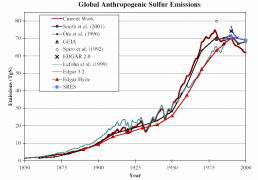
Es gibt deutliche Unsicherheiten bei der Abschätzung der weltweiten Emissionen von Schwefeldioxid und Stickoxiden. Die natürlichen Emissionen an SO2 werden auf 25% bis 50% der globalen Emissionen geschätzt. In den städtischen und industrialisierten Räumen können menschliche Quellen bis zu 90% zur Belastung der Luft mit diesen Gasen beitragen. Die Unsicherheiten schwanken von Region zu Region. Oft sind nicht genügend Daten vorhanden. Vor allem der landwirtschaftliche Beitrag ist nicht gut bekannt und es mangelt an Flussmessungen aus Böden und Gewässern. Abb. 3 zeigt die Ergebnisse einiger Untersuchungen. Es ist zu beachten, dass die Angaben in Abb. 3 + 4 auf reinen Schwefel bezogen sind, in Abb. 2 jedoch auf Schwefeldioxid.
|
 |
 |
 |
|
3. Entwicklung der weltweiten vom Menschen verursachten Schwefel-Emissionen. Die Abschätzungen verschiedener wissenschaftlicher Studien werden in dem Diagramm oben verglichen.
Quelle: S. J. Smith, R. Andres, E. Conception, J. Lurz, 2004, Sulfur dioxide emissions: 1850-2000 (JGCRI Report. PNNL-14537)
Bitte zum Vergrößern anklicken! (26 K)
|
|
Veränderungen in den Emissionen
Die Menschen haben die natürliche Rate der Stickstoff-Fixierung verdoppelt und die atmosphärische Deposition von Stickstoff hat sich seit der vorindustriellen Zeit verdreifacht bis verzehnfacht. Unter Deposition verstehen wir die Menge eines Stoffes, die durch Absinken oder Auswaschung mit dem Regen aus der Luft auf die Erde niedergeht. Auch die Emissionen an Schwefel in die Atmosphäre haben sich mehr als verdoppelt.
|
 |
 |
|
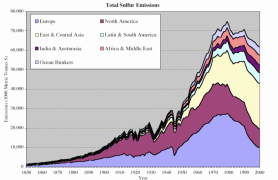
4. Beiträge der wichtigen Wirtschaftsräume in der Welt zu den vom Menschen verursachten Schwefel-Emissionen seit 1850
Quelle: S. J. Smith, R. Andres, E. Conception, J. Lurz, 2004, Sulfur dioxide emissions: 1850-2000 (JGCRI Report. PNNL-14537)
Erklärung: Austurasia - Australien, Neuseeland, Südost-Asien; Ocean Bunkers - für transozeanische Schiffstransporte genutzte fossile Brenntstoffe
Bitte die Abbildung zum Vergrößern anklicken! (66 K)
|
|
 |
Seit der industriellen Revolution dominierten in Europa und Nordamerika die menschlichen Beiträge zu den globalen Schwefel-Emissionen. In den letzten Jahrzehnten sind es jedoch die steigenden Emissionen in Ost- und Zentralasien, die für den weiteren weltweiten Anstieg verantwortlich sind. Schwefeldioxid in der Luft stieg auf Grund der Industrialisierung und des damit verbundenen Verbrauchs an Kohle Ende des 19. Jahrhunderts in Europa stark an. Seit 1945 erhöhte sich auch der Ölverbrauch ständig. Die Emissionen an Schwefel verdoppelten sich nochmals zwischen dem Ende des zweiten Weltkrieges und dem Jahr 1970.
|
|
Derzeit betrifft das Problem des sauren Regens vor allem die Regionen mit schnell wachsender Wirtschaft und steigendem Energieverbrauch in Asien. Hier wird erwartet, dass sich die SO2 Emissionen zwischen 1990 und 2010 verdreifachen, wenn sich die derzeitigen Trends fortsetzen. Den bereits beträchtlichen Schaden durch sauren Regen in Asien zu beschränken und weiteren großen Schaden für die Zukunft zu vermeiden, wird Investitionen in die Abgas-Kontrolle in einer Größenordnung verlangen, wie sie in den letzten 20 Jahren in Europa und Nordamerika getätigt wurden. So betrugen die Schwefeldioxidemissionen in Europa (EU25) 2004 nur noch 29% der Werte im Jahr 1990. Für die Stickoxidemissionen waren es jedoch noch 68%. Die USA und Kanada verzeichneten einen 28%igen Rückgang in den SO2-Emissionen zwischen 1980 und 1995.
|
Verwandte Seiten:
Mehr über die Verursacher von Emissionen in bestimmten Wirtschaftszweigen erfahren wir aus den Texten in:
Klima in Städten - Basis - Einheit 1
Weitere Informationen zum sauren Regen bieten die Texte der Einheit 3 im Teil Basis und im Teil Mehr.
|
About this page:
authors: Anita Bokwa - Jagiellonian University, Cracow, Poland and Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz, Germany
educational reviewing: Michael Seesing - University of Duisburg, Duisburg, Germany
last update: 2004-12-17
Übersetzung 2004 und letzte Aktualisierung 2007-09-07: Elmar Uherek - MPI für Chemie, Mainz
|
|
 |
|







