|
|
 |
|
|
|
 |
| |
|
|
 |
Alsó légkör
Haladó
|
Oxidáció a légkörben
Számos kémiai vegyület jut a légkörbe, és felhalmozódna, ha ismételten nem kerülne onnan ki. A kiülepedés történhet száraz ülepedéssel, vagy eső révén (nedves ülepedés). Különösen a gáznemű szerves vegyületek kerülnek ki a légkörből könnyen, ha átalakulnak kevésbé illékony, vízoldható oxidált állapotba…
|
|
|
|
|
 |
 |
 |
|
1. Az OH gyök tisztítja a levegőt
kép: Elmar Uherek
|
|
 |
Az oxidáció kémiai értelemben nem szükségszerűen jelent egy oxigént tartalmazó molekulával való reakciót. De a levegő a legtöbb esetben oxigént is tartalmaz. Három fő oxidáns van, ami az ilyen jellegű folyamatokat irányítja a légkörben:
A hidroxil gyök OH
a nitrát gyök NO3
az ózon molekula O3
A HO2 gyökök is fontosak, és gyakran az OH-t és a HO2-t együttesen HOx-nek is nevezik. A legfontosabb oxidáns azonban a hidroxil gyök, az OH. Nagyon aktív és képes oxidálni a troposzférában képződött legtöbb vegyi anyagot.
Ezért az OH-t gyakran nevezik a 'légkör mosószerének'.
|
Csak néhány összetevő, mint a halogénezett szénhidrogének, CFC-k (például a CF2Cl2), dinitrogén–oxid, N2O vagy a széndioxid, CO2, az, amelyek olyan stabilak, hogy nem lépnek reakcióba, vagy csak nagyon lassan az OH-val. A metán, CH4, reakciójának sebessége körülbelül 100-1000-szer lassúbb, mint más szerves vegyületeké. Ez a magyarázata annak, hogy a metán koncentrációja miért lehet olyan magas a légkörben (körülbelül 1.7 ppm = 1.7 µmol/mol), amíg más szerves nyomgáz koncentrációja alacsonyabb, mint 1 ppb (= 1nmol/mol)*.
|
 |
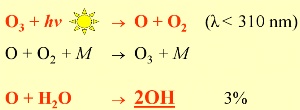 |
 |
|
2. OH képződés: >97% az O atomoknak az ózon fotolíziséből származik, amik újból ózont képeznek. Csak <3% vesz részt a légkör legfontosabb gyökének az OH-nak a kialakításában.
Ha két molekula vagy atom, A és B összeütközik, és létrehoz egy harmadik molekulát C-t, szükséges egy harmadik M partner, azért hogy elszállítsa a fölösleges energiát. Ez az anyag (általában a nitrogén, az N2) nem lép reakcióba ezekkel.
|
|
 |
 |
|
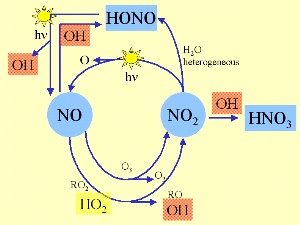
3. OH és a nitrogén-oxid körfolyamat
vázlat: Elmar Uherek
A nagyításhoz kattints a képre! (90 K)
|
|
 |
Hogyan képződik az OH?
Az OH irányítja a légköri kémiát a nap folyamán, mert képződése elsősorban a Napból érkező sugárzástól függ. A kezdő reakció (fent) a napfény hatására történő ózonbomlás (fotolízis), ami 310 nm-nél rövidebb hullámhosszú sugárzás hatására játszódik le, majd ezt követi a kialakult oxigén atom reakciója a vízzel. Ezért egy bizonyos mennyiségű troposzférikus ózon alapvető a troposzféra kémiájához, habár a túl sok nem egészséges.
Az OH más forrásai a salétromossav, hidrogén peroxid H2O2 és a peroxi- metán CH3OOH fotolízisei, a NO reakciója a hidroperoxi gyökkel HO2 vagy az alkének reakciója az ózonnal. A baloldalon lévő vázlat azt mutatja, hogy az OH-t milyen módon fonódik egybe a nitrogén-oxidok nappali körfolyamatával.
|
Mennyi OH képződik?
Mivel az OH rendkívül reagens gyök, kialakulása után azon nyomban reakcióba lép. Élettartama körülbelül egy másodperc vagy még kevesebb. Ez azt jelenti, hogy a koncentrációja nagyon alacsony, 1x105 és 2x107 molekula cm-3 között. Tengerszinti nyomáson ez 0.01 - 1 ppt (pmol/mol) keverési arányt jelent.
Mivel a képződés függ a vízgőz mennyiségétől, az OH mennyisége csökken a magassággal (hidegebb és szárazabb a levegő).
|
 |
 |
 |
|
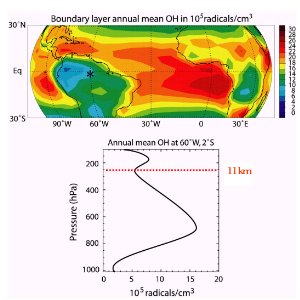
4. Az OH övezetes eloszlása
A 250 hPa szint nagyjából a 11 km-es magasság (közepes szélességeken ez a tropopauza magassága). Az 1000, 800, 600 és a 400 hPa szinteknek mi a magassága? Használd a nyomás és a magasság kapcsolatát ábrázoló diagramot!
forrás: J. Lelieveld - MPI Mainz 2003 előadása
A nagyításhoz kattints a képre! (80 K)
|
|
De különösen a szélességgel csökken, mert nem csak a nedvességtartalom csökken, hanem a sarkok felé a napfénytartam és intetnzitás is.
Hogyan lép az OH reakcióba?
A jobboldalon lévő kép egy érdekes hatást mutat trópusi esőerdők fölött. Az OH koncentráció csökken a talaj közelében. Mi ennek az oka? Az erdők sok szerves vegyületet, mindenek előtt izoprént bocsátanak ki, és az reakcióba lép az OH-val. Ezért van az erős OH koncentráció-csökkentő folyamat a talajhoz közel. A kémiai reakciók használják fel. Az OH-nak nagy affinitása van a szerves vegyületekből, RH, elvonja a hidrogént amikor csak lehetséges, és vizet H2O hoz létre. A következő lépésben az R gyök reakcióba lép az oxigénnel, O2, és szerves peroxidot hoz létre, ami például alapvető az ózonképződés körfolyamatában. gyök reakcióba lép az oxigénnel, O2, és szerves peroxidot hoz létre, ami például alapvető az ózonképződés körfolyamatában.
|
 |
 |
 |
|
5. OH eloszlása a trópusokon.
felül: globális eloszlás a trópusi területeken
alul: A manausi esőerdőben lévő állomáson mért profil (Brazília)
forrás: J. Lelieveld MPI Mainz 2003 előadása
A nagyításhoz kattints a képre!(80 K)
|
|
|
Azonban, az OH világszerte elsősorban nem az erdőkből származó szerves vegyületekkel lép reakcióba. A szerves gázok 30%-kal, a metán (a legfontosabb és a legkisebb szerves molekula) további 15%-kal járul hozzá az OH eltávolításhoz. A gáz, ami leginkább reakcióba lép az OH-val a szénmonoxid (40%) és a fennmaradó 15%-ban az ózonnal, O3, hidroperoxil gyökkel, HO2 és hidrogénnel, H2, lép reakcióba.
|
 |
 |
|
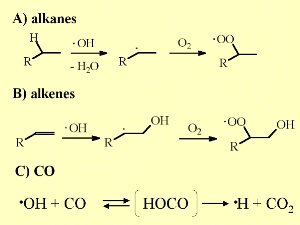
6. A fontos OH reakciók a troposzférában.
A nagyításhoz kattints a képre! (45 K)
|
|
 |
Az OH igyekszik kialakítani kétszeres kötést kölcsönhatásában a kicsi alkénekkel, a szerves vegyületek speciális osztályával, addig, míg a telített maradék nem sokkal nagyobb és a H elvonás statisztikailag megfelelő. Itt peroxid képződés is előfordul.Az OH képes oxidálni a szénmonoxidot, CO, széndioxiddá CO2. Amint láttuk a CO és a metán, CH4, a fő OH nyelők. Más reagens szerves vegyületek csak nyomokban, néhány ppt mennyiségben fordulnak elő, amíg a CO átlagos szintje eléri a 120 ppb-t az északi féltekén (több égési folyamat) és a 60 ppb-t a déli féltekén.
|
Habár az OH a legfontosabb oxidáns a légkörben, az éjszakai koncentrációja közel van a nullához, mert a napfény szükséges a képződéséhez. Ezért a sötétben és az éjszaka a nitrátok, NO3, és az ózon O3, kémiája sokkal fontosabbá válik.
|
 |
 |
 |
|
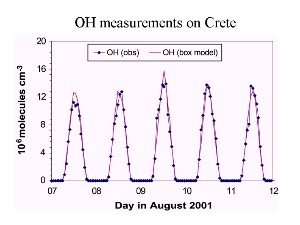
7. Az OH koncentráció időbeli profilja néhány napon keresztül.
forrás: J. Lelieveld MPI Mainz 2003 előadása
|
|
* A keverési arányt ppb-t és ppm-t (= 1 molekula 1 milliárd közül vagy 1 molekula 1 millió közül) gyakran használják tudományos publikációkban, illetve más légköri és éghajlati irodalomban is. Mi is használtuk az Éghajlati Enciklopédiában. Azonban, sokkal helyesebb az 1 nmol/mol (= 1 ppb) vagy 1 µmol/mol (= 1 ppm). Ugyanis a molekulák mennyiségének, n-nek a mértékegysége a mol.
|
Az oldalról:
szerző: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz
tudományos lektor: Dr. Mark Lawrence - Max Planck Institute for Chemistry, Mainz 2004-05-05
pedagógiai lektor: Michael Seesing - Uni Duisburg - 2003-07-02
utolsó módosítás: 2004-05-07
|
|
 |
|







