|
|
 |
|
|
|
 |
| |
|
|
 |
Az óceánok
Alap |
A víz speciális tulajdonságai
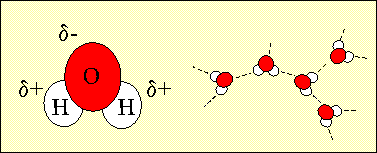
A Föld 71 %-a vízzel borított, és ennek a víznek a 97 %-a az óceánokban van. A víz két atom hidrogénből és egy oxigénatomból áll. A víz elektronstruktúrája miatt az oxigénatom gyengén negatív töltésű, a hidrogén atom pedig gyengén pozitív töltésű. Amikor a vízmolekulák közel kerülnek egymáshoz, a negatív és a pozitív töltésű részek vonzzák egymást. Ez a vonzási kölcsönhatás a hidrogénkötés. A hidrogénkötések az okozói a víz speciális tulajdonságainak, amelyek lehetővé teszik az életet a Földön.
|
 |
 |
|
1. A víz szerkezetén láthatjuk az oxigén atom gyenge negatív töltését, és a hidrogén atom gyenge pozitív töltését. A vízmolekulák ezen elektromos szerkezetük miatt képesek hidrogénkötés kialakítására másik vízmolekulával. Szerző: Lucinda Spokes.
|
|
|
|
|
 |
- A víz az egyetlen természetes anyag, amit a Földön megtalálhatunk, mint gáz (vízgőz), folyadék és szilárd anyag (jég).
|
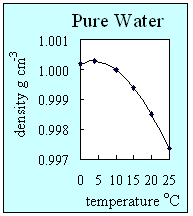
- A sűrűség egy mérték, ami megmutatja, hogy mennyire tömör egy anyag. Úgy határozzuk meg, hogy az anyag tömegét elosztjuk a térfogatával. A szilárd anyagok majdnem minden esetben a legsűrűbbek, aztán a folyadékok, végül a gázok. A hőmérséklet növekedésével a sűrűség általában csökken. A tiszta víz kivétel ez alól, ez az egyetlen olyan anyag, melynek folyadékként legnagyobb a sűrűsége. A víz 4 °C körül a legsűrűbb. Ez azért van, mert a vízmolekulák közötti hidrogénkötés a jégnek egy nagyon stabil nyílt struktúrát ad. Alacsony hőmérsékleten a víznek nagyobb a sűrűsége, mint a jégnek, ami azt jelenti, hogy a jég úszik a vízen.
|
 |
 |
 |
|
2. A tiszta víz sűrűsége hogyan változik a hőmérséklettel. Ez az ábra mutatja, hogy a tiszta víznek folyadék állapotban 4 oC-on van a legnagyobb sűrűsége. Szerző: Lucinda Spokes.
|
|
 |
 |
|
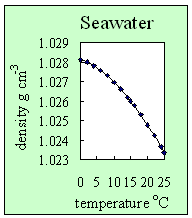
3. A tengervíz hőmérséklete hogyan változik a hőmérséklettel. Rögzített sókoncentráció mellett (ebben az esetben 35 ezrelék), a tengervíz sűrűsége csökken a hőmérséklettel. Szerző: Lucinda Spokes.
|
|
 |
- Sót adva a vízhez növekszik a sűrűsége. Ez meggátolja a hidrogén kötések kialakulását. is Ez azt jelenti a tengervíznél, eltérően a tiszta vízhez, hogy a sűrűség maximuma nem 4 °C-nál van, hanem mikor jéggé alakul, azaz fagyáskor. Ez azt is jelenti, hogy a tengervíz 0 °C alatt fagy meg (ezért szórnak sót az utakra hideg éjszakákon, hogy csökkentsék a jég kialakulásának kockázatát).
|
- A víznek nagyon nagy a fajlagos hőkapacitása. Ez azt jelenti, hogy sok energia szükséges ahhoz, hogy a hőmérsékletét növelje (az energia ahhoz kell, hogy felbontsa a hidrogénkötéseket). Mivel a Föld 71% víz, a Napból érkező energia csak kis változást okoz a bolygó hőmérsékletében. Ez gátolja meg, hogy túl meleg vagy túl hideg legyen, és lehetővé teszi a feltételeket az élethez. A hőt az óceánok nyáron tárolják, és télen visszasugározzák a légkörbe. Az óceán ennek következtében mérsékli az éghajlatot, csökkenti az évszakok közötti különbségeket.
|
 |
 |
 |
|
4. Négyszer több energia szükséges ahhoz, hogy 1 °C felmelegítsük a vizet, mint a levegő esetében. Szerző: Lucinda Spokes.
|
|
- A víznek a párolgási hője is magas. Ez azt jelenti, hogy sok napenergia szükséges ahhoz, hogy folyadékból vízgőz legyen. Mivel a vízgőz a melegebb területek felől a hidegebb felé mozog, visszaalakul folyadékká, és esőt okozhat. Ez felszabadítja a hőt, ami felmelegíti a levegőt. A hatalmas mennyiségű energia magába foglalja a földi viharok és szelek erejét.
- Számos anyag oldódik a vízben és stabilizálódik a hidrogén kötéssel. Ez teszi lehetővé az oxigén, széndioxid, tápanyagok és a szennyező anyagok szállítását a vízben és lehetővé teszi a biológiai folyamatokat.
- Mivel az olaj molekulák nagyok, és elektromosan nem töltöttek, nem tudnak kisebb töltött molekulákra bomlani, és stabilizálódni a vízben. Ez azt jelenti, hogy nem oldódnak a vízben.
|
 |
 |
|
5. Kép a hullámokról, ahogyan egy kutatóhajó oldalához csapódnak Wendy Broadgate. Más képek: NOAA.
|
|
Az oldalról:
szerző: Lucinda Spokes - Environmental Sciences, Kelet Angliai Egyetem, Norwich - Anglia
1. tudományos lektor:
2. tudományos lektor:
pedagógiai lektor:
utolsó módosítás: 2003-12-10
|
|
 |
|







