|
|
 |
|
|
|
 |
| |
|
|
 |
Untere Atmosphäre
Basis |
Stickoxide - Bildung und Bedeutung
Stickoxide spielen eine wichtige Rolle in atmosphärischen Prozessen. Wie werden sie gebildet? Warum sind sie wichtig?
|
1. Straßenverkehr - immer noch eine Hauptquelle von Stickoxiden.
© FreeFoto.com
|
|
|
|
|
 |
Woher kommen Stickoxide?
Die wichtigsten Stickoxide sind Stickstoffmonoxid NO und Stickstoffdioxid NO2. Beide zusammen werden als NOx bezeichnet. Die Stickstoffmoleküle der Luft (N2) sind sehr stabil und es ist nicht einfach, sie zu oxidieren. Einige Bakterien haben spezielle Mechanismen entwickelt, die N-N Dreifachbindung zu knacken und oxidierte Verbindungen zu bilden. Aber weit wichtiger sind Prozesse, in denen die Bindung durch Hitze gebrochen wird. Dies ist nur unter extremen Bedingungen möglich. Ein Beispiel ist die Verbrennung von Treibstoff in einem Automotor. Der Hauptteil des vom Menschen erzeugten NOx stammt aus dieser Quelle. Aber auch andere sehr heiße Reaktionen können die Ursache sein, z.B. die heißesten Teile der Flammen bei Waldbränden. Auch Blitze sind eine bedeutende Quelle. Im Kanal eines Blitzes können Temperaturen von bis zu 30.000 °C erreicht werden und mit Leichtigkeit Stickstoffbindungen aufgebrochen werden.
2. rechts: Blitze sind eine weitere wichtige Quelle von Stickoxiden.
 Bild: Bernhard Mühr / Karlsruher Wolkenatlas Bild: Bernhard Mühr / Karlsruher Wolkenatlas
|
 |
|
 |
 |
|
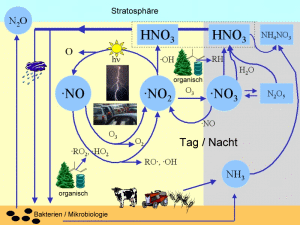
3. Wo sind Stickstoffoxide in atmosphärische Prozesse involviert? Das Schema gibt einen kleinen (nicht vollständigen) Überblick wichtiger Reaktionswege in der Atmosphärenchemie.
Bitte Bild zum Vergrößern anklicken! (100 K)
Grafik: Elmar Uherek
|
|
 |
Wo sind sie wichtig?
Wir finden NOx (= NO + NO2) und andere Oxide des Stickstoffs fast überall in der Atmosphärenchemie. Während der Nacht werden Stickstofftrioxid-Radikale NO3 gebildet und sind die aktivsten oxidierenden Verbindungen. Radikale sind sehr instabile Moleküle, die sehr schnell reagieren.
Bildet sich in Gebieten mit hoher Luftverschmutzung N2O5 (siehe Reaktionswege links), so kann es an Tröpfchen und feuchten Oberflächen mit Wasser reagieren und Salpetersäure HNO3 bilden. HNO3 trägt zum sauren Charakter des sauren Regens bei. Salpetersäure kann sich bei Tag auch durch die Oxidation von NO2 bilden.
|
|
Die Säure ist der Hauptweg, wie Stickoxide wieder aus der Atmosphäre entfernt werden, entweder durch trockenes Absetzen an Oberflächen (trockene Deposition) oder durch Auswaschung durch Regen (feuchte Deposition). Salpetersäure finden wir auch in den polaren Stratosphärenwolken. Hier bildet sie mit Wasser Eispartikel, an denen sich das Ozonloch bildet (siehe: Obere Atmosphäre - Mehr - Einheit 2).
|
|
Namen von Stickstoffverbindungen:
|
Formel |
Systematischer Name |
Trivialname |
|
NO |
Stickstoffmonoxid |
Stickoxid |
|
N2O |
Distickstoffmonoxid |
Lachgas |
|
NO2 |
Stickstoffdioxid |
|
|
N2O5 |
Distickstoffpentaoxid |
Salpetersäure-Anhydrid |
|
N2O3 |
Distickstofftrioxid |
|
|
HNO3 |
- |
Salpetersäure |
|
NH3 |
- |
Ammoniak |
|
|
Stickstoffoxide sind als Gase sehr wichtig für die Bildung und den Abbau von troposphärischem, d.h. bodennahem Ozon, denn sie sind in viele atmosphärische Kreisläufe verwickelt. Sie dienen als Katalysatoren, als Stoffe, die wieder unverändert aus einem Reaktionskreislauf hervorgehen. Hierbei wird NO2 durch das Sonnenlicht gespalten, bildet NO und NO wird wieder zu NO2 oxidiert. Sowohl Ozon als auch organische instabile hoch oxidierte Verbindungen, sogenannte Peroxide, können die Oxidation antreiben. Details erklärt der nächste Text.
Der Hauptgrund für die Erfindung des Auto-Katalysators war, dass man die hohe Konzentration von Stickoxiden in den Abgasen zu vermeiden suchte. Wir Menschen haben zu viel von ihnen in die Atmosphäre entlassen, vor allem durch Verbrennungsprozesse und aus dem Autoverkehr. So wurde das natürliche Gleichgewicht in der Luft gestört.
Distickstoffmonoxid N2O, besser bekannt als Lachgas, wird in mikrobiologischen Abbauprozessen durch Bakterien gebildet. Es reagiert in der Troposphäre nicht, sondern wandert langsam hoch in die Stratosphäre. Hier wird es durch Licht gespalten.
Ammoniak NH3 ist das bedeutendste basische Gas der Atmosphäre. Es stammt z.B. aus Viehhaltung und Düngung, aber auch aus mikrobiologischen Abbauprozessen. Mit Salpetersäure kann es Salzpartikel von Ammoniumnitrat NH4NO3 bilden.
|
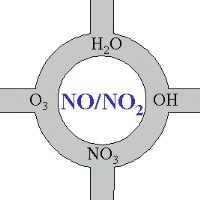
Stickoxide als Knotenpunkte atmosphärischer Chemie
Auch wenn wir die Chemie der Stickstoffoxide nicht im Detail betrachtet haben, so können wir uns doch merken, dass diese Verbindungen in gewisser Weise das Herz der Atmosphärenchemie sind. Ein großer Teil derjenigen chemischen Verbindungen, die oxidiert und aus der Atmosphäre entfernt werden oder in andere Verbindungen umgewandelt werden, kommen hierbei direkt oder indirekt mit der Chemie von NO oder NO2 in Berührung.
|
 |
 |
 |
|
4. Stickoxide - im Zentrum der atmosphärischen Chemie
Bild: Elmar Uherek
|
|
|
About this page:
author: Dr. Elmar Uherek - MPI for Chemistry, Mainz
scientific reviewing: Dr. Rolf von Kuhlmann, MPI for Chemistry, Mainz
educational proofreading: Michael Seesing - Uni Duisburg - 2003-07-02
revised and last published: 2004-04-30 | |
|
 |
|







