|
|
 |
|
|
|
 |
| |
|
|
 |
A alta atmosfera
Básico |
Os clorofluorcarbonetos (CFC) e o buraco do ozono
A história do buraco do ozono é um bom exemplo de como uma classe aparentemente inofensiva de compostos químicos pode tornar-se um verdadeiro perigo para a vida na Terra, e de como os governos, a indústria e a sociedade civil podem trabalhar juntos na identificação de um problema e actuar para a sua solução.
|
|
|
|
|
 |
|
Daqui podemos aprender que qualquer alteração que o Homem provoque no sistema climático pode perturbar o equilíbrio natural de uma forma inesperada. Vemos também que se a comunidade mundial trabalhar de forma concertada num objectivo, os problemas ambientais podem efectivamente ser resolvidos.
Os CFC são apenas uma classe entre outras substâncias químicas que destroem a camada do ozono, mas são a classe mais importante.
|
A utilização e as propriedades dos CFC
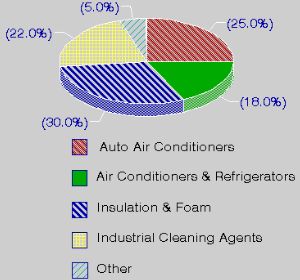
Os clorofluorcarbonetos são compostos de carbono completamente halogenados como CFCl3 ou CF2Cl2 (comercialmente eles são bem conhecidos como FREON, apesar de este ser o nome de uma marca). Os CFC têm sido utilizados numa larga variedade de passos de manufacturação e de produtos, incluindo refrigerantes, solventes na indústria electrónica, propulsores de aerosóis, agentes para extinção de incêndios, solventes para limpeza a seco, agentes desengordurantes, são um componente chave na fabricação de espuma rígida para isolamento de casas e em outras aplicações no lar, e de espuma isolante acondicionadora de material.
A razão para a sua utilização tão alargada é simples: eles não afectam a saúde humana uma vez que os gases são completamente inertes. Eles não reagem com nenhum composto natural, nem no nosso corpo, nem na troposfera. Este é também o motivo porque os CFC têm um tempo de vida tão longo e se podem acumular no ar. A propriedade fatal destes compostos, que não foi tida em consideração, foi que eles são fotolisados pela radiação UV emitida pelo Sol.
|
 |
 |
 |
|
1. A utilização dos CFC
Informação da US Environmental Protection Agency (EPA)
|
|
 |
 |
|
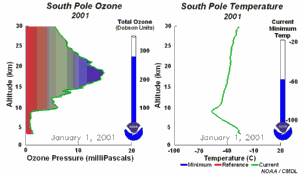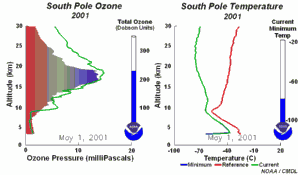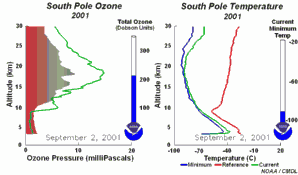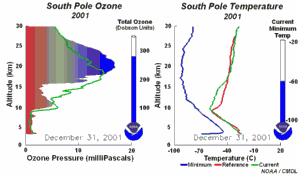
2. O desenvolvimento do buraco do ozono em 2001
Prima para aumentar a sequência de 5 dias! (270 K)
Animação original cedida por NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado
|
|
 |
O destino dos CFC – a estratosfera
Uma vez que a intensa radiação solar UV-B é retida pela camada do ozono na estratosfera, a radiação UV que atinge a troposfera é demasiado fraca para degradar significativamente os CFC. Contudo, este processo vai ocorrendo à medida que os CFC penetram lentamente na estratosfera. Embora esta decomposição conduza à formação de radicais cloro e fluor, esta não provoca necessariamente uma forte depleção do ozono, uma vez que os compostos de cloro (os principais responsáveis pela depleção do ozono) sofrem também outras reacções, dependendo das condições meteorológicas. Apesar de o ozono estratosférico estar a ser reduzido também em outras latitudes, o buraco do ozono é formado apenas em regiões polares, em particular sobre a Antártida e apenas durante a primavera. Qual será a razão ?
|
A reacção química
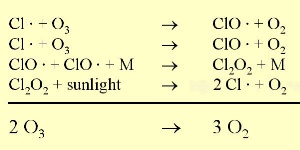
O ozono encontra-se num estado de equilíbrio na camada do ozono, sendo formado e decomposto devido à radiação UV. Os radicais cloro (Cl) são catalizadores que apenas lideram numa reacção em cadeia para a depleção do ozono. Eles são muito eficientes na depleção do ozono, pois apenas são reciclados e não são destruídos durante esta reacção.
|
 |
 |
 |
|
3. A reacção cloro ozono. Os pontos indicam que os parceiros na reacção são radicais.
(35 K)
|
|
As condições
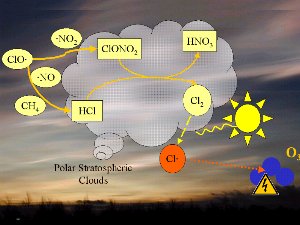
A decomposição dos CFC conduz, após outras reacções, à formação de radicais ClO, que por sua vez reagem com o dióxido de nitrogénio, NO2 e forma ClONO2 ou com o monóxido de nitrogénio, NO, e o metano, CH4, e forma HCl; da reacção ClONO2 com HCl forma-se também ácido nítrico, HNO3. Não iremos focar em detalhe a química, mas é importante saber que nenhum dos produtos (HCl e ClONO2) reage com o ozono e que são compostos relativamente estáveis. Apenas certas condições conduzem a químicos reactivos que finalmente causam o buraco do ozono. Foram necessários dois a três anos de investigação intensiva após a descoberta do buraco do ozono em 1985 numa estação de investigação britânica na Antártida, para que estas complexas condições tenham sido completamente compreendidas.
|
 |
 |
|
4. A química nas nuvens estratosféricas polares conduz à formação de perigosos radicais cloro Cl (vermelho).
Prima para aumentar! (100 K)
|
|
 |
1) Um factor determinante são as temperaturas estratosféricas extremamente baixas, de cerca de -80°C ou menos sobre a Antártida, durante a noite polar. Durante tais condições o ácido nítrico e água formam nuvens estratosféricas de gelo, que não são estáveis em temperaturas mais elevadas. À superfície destas nuvens de gelo, o HCl e o ClONO2 reagem um com o outro formando ácido nítrico e cloro puro, Cl2.
2) O cloro, Cl2, é uma molécula estável que não reage com o ozono, mas é facilmente fotolisada pela radiação, formando 2 radicais Cl, que atacam o ozono (seta em cor-de-laranja).
|
Como vimos em cima é o radical cloro, Cl, que origina a depleção do ozono. Esta não ocorre antes de a radiação solar estar disponível, i.e. na primavera antárctica. Assim, o buraco do ozono é observado todos os anos, na mesma altura, em Setembro e Outubro. A reacção em cadeia decorre enquanto os cristais das nuvens de gelo não se fundem e os radicais Cl não são removidos por outras formas.
|
 |
 |
 |
|
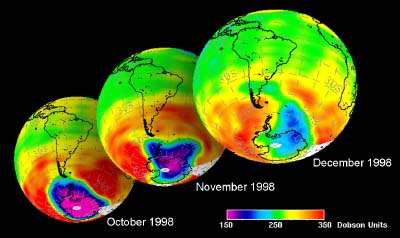
5. O desenvolvimento do buraco do ozono durante a primavera antárctica de 1998
dados de GOME
|
|
 |
 |
|
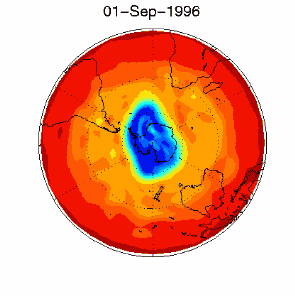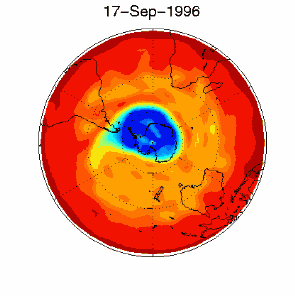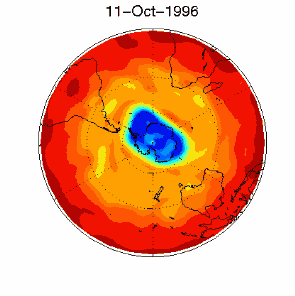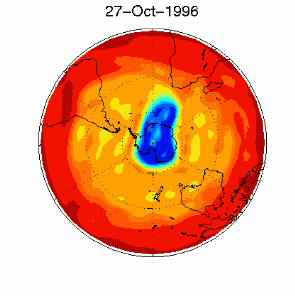
6. O buraco do ozono no vórtice polar sobre a Antártida em Setembro / Outubro 1996
adaptado da base de dados de UKMO, publicado na Brown University
Prima para obter uma versão com mais resolução! (330 K)
|
|
 |
3) Finalmente, todo este processo não deveria ser tão dramático e não deveria afectar a região mais concentrada da camada do ozono polar entre 14 km e 22 km de altitude, pois o composto ClO é geralmente formado em altitudes elevadas. Assim, é necessário que ocorra na estratosfera um transporte descendente para transportar o ClO para regiões inferiores, o que acontece apenas no denominado vórtice polar. Aqui, ocorrem condições meteorológicas especiais, numa espécie de vento circumpolar em torno da Antártida.
Como vemos, as condições necessárias à formação do buraco do ozono (temperaturas extremas na noite polar, formação de nuvens de gelo, vórtice polar seguido do nascer do sol polar) são tão especiais que este processo nunca teria sido previsto pelos cientistas se não tivesse sido observado.
|
O futuro do buraco do ozono
Entretanto os CFC foram banidos à escala global (Protocolo de Montreal sobre substâncias que provocam a depleção da camada do ozono – 1987 e adendas seguintes). Devido ao seu longo tempo de vida, ainda irão decorrer cerca de 50 anos até que os CFC libertados até ao momento tenham sido removidos novamente da estratosfera e o equilíbrio do ozono seja novamente estável. Admite-se que pelos anos próximos de 2000 se tenha atingido o máximo. Verifica-se que o buraco do ozono tem tido dimensões relativamente estáveis durante os últimos anos. Contudo, excepções são sempre possíveis: em 2002 não foi observado buraco do ozono significativo. A razão foi simples: as temperaturas foram demasiadamente elevadas e o vórtice polar não se formou da forma habitual. Este é um outro exemplo de como os processos atmosféricos ignoram por vezes qualquer previsão. Mas em 2003 o buraco do ozono surgiu com as dimensões anteriores, tendo sido mesmo o segundo maior alguma vez observado.
|
 |
 |
 |
|
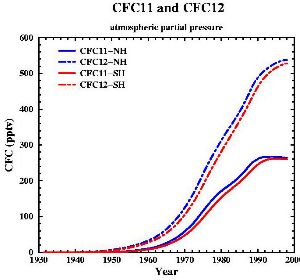
7. O desenvolvimento das concentrações dos dois mais importantes CFC (também denominados FREON 11 e FREON 12).
dados de: Walker et al., J. Geophys. Res., 105, 14,285-14,296, 2000 [internet plots]; figura de: Gian-Kasper Plattner (Univ. of Bern, UCLA)
|
|
Acerca desta página:
Autor: Elmar Uherek - MPI Mainz
1. Revisão científica: Dr. Rajendra Shende, Head Energy and Ozone Action, United Nations Environment Programme 2003-10-06
2. Revisão científica: Dr. John Crowley - MPI for Chemistry, Mainz 2004-05-06
Revisão educacional: Hendrik Förster & students, Nordpfalz Gymnasium Kirchheim-Bolanden - March 2004
Versão portuguesa: Margarida L. R. Liberato - Dep. de Física, UTAD, Portugal
Última actualização: 2004-05-10
|
|
 |
|







