|
|
 |
|
|
|
 |
| |
|
|
 |
Baixa atmosfera
Básico |
Óxidos de azoto - Formação e relevância
Os óxidos de azoto jogam um importante papel nos processos atmosféricos. Como é que são eles formados, porque são eles importantes?
|
1. Tráfego - ainda uma importante fonte de óxidos de azoto.
(c) FreeFoto.com |
|
|
|
|
 |
Qual a origem dos óxidos de azoto?
O óxido de azoto mais importante é o monóxido de azoto NO e o dióxido de azoto NO2. Ambos juntos são chamados de NOx. As moléculas de azoto (N2) no ar são muito estáveis e não é fácil oxida-las. Poucas bactérias desenvolveram mecanismos especiais para quebrar a ligação tripla N-N e formarem compostos oxidados. Mas muito mais relevante são os processos onde as ligações são quebradas pelo calor. Isto pode apenas acontecer sob condições extremas. Um exemplo é durante a combustão no motor dos veículos automóveis. A maior parte do NOx antropogénico (= feito pelo ser humano) provém desta fonte. Também pode acontecer durante outras reacções muito quentes, por exemplo nas partes mais quentes das chamas de biomassa a arder. Finalmente os relâmpagos são uma fonte importante. Durante a faísca as temperaturas atingem aproximadamente até 30000 graus Celsius e facilmente partem as ligações do azoto.
2. direita: Os relâmpagos são outra fonte importante de óxidos de azoto.
imagem por Bernhard Mühr  Karlsruher Wolkenatlas Karlsruher Wolkenatlas
|
 |
|
 |
 |
|
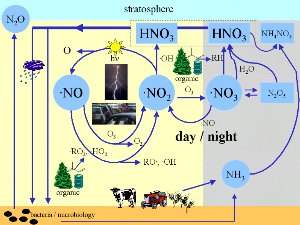
3. Onde estão envolvidos os óxidos de azoto nos processos atmosféricos? O esquema dá uma pequena (não completa) visão dos importantes processos na química da atmosfera.
Prima para aumentar! (100 KB)
por Elmar Uherek para ESPERE
|
|
 |
Onde estão eles envolvidos?
Podemos encontrar NOx (= NO + NO2) e outros óxidos de azoto em quase todos os sítios da química atmosférica. Durante a noite, os radicais de nitrato NO3 são formados e são os mais activos oxidantes. Os radicais são espécies químicas, as quais são muito instáveis e normalmente reagem extremamente rápido.
Se N2O5 é formado em áreas poluídas, pode reagir em gotas ou superfícies húmidas com água e o ácido nítrico HNO3 é formado. HNO3 contribui para o caracter ácido da chuva. O ácido nítrico, que pode também ser formado durante o dia pela oxidação do NO2, é o principal caminho para os óxidos de azoto serem removidos novamente pela atmosfera, tanto pela deposição seca , como pela deposição húmida (saída por lavagem da chuva).
O ácido nítrico é também parte das nuvens polares estratosféricas. O ácido nítrico tri-hidratado forma as partículas onde o buraco de ozono é desenvolvido (detalhes em 'Alta atmosfera - Mais - Unidade 2').
|
|
Nomes de compostos de azoto:
|
Fórmula |
Nome Systematico |
Nome Comum |
|
NO |
monóxido de nitrogênio |
óxido nítrico |
|
N2O |
monóxido de dinitrogênio |
óxido nitroso |
|
NO2 |
dióxido de nitrogênio |
peróxido de azoto |
|
N2O5 |
pentóxido de dinitrogênio |
anidrido nitrico |
|
N2O3 |
trióxido de dinitrogênio |
anidrido nitroso |
|
HNO3 |
- |
ácido nítrico |
|
NH3 |
- |
amoníaco |
|
|
Os óxidos de azoto enquanto gases são muito importantes para a formação e degradação do ozono troposférico, porque estão envolvidos em coclos catalíticos. Isto é principalmente, porque o NO2 pode ser sujeito a fotólise pela radiação solar. Neste processo forma-se NO e este NO é oxidado novamente em NO2. O ozono assim como os radicais peróxidos orgânicos (compostos oxidados instáveis) pode ser envolvido neste ciclo como podemos ver em detalhe no texto seguinte. A principal razão para a invenção do conversor catalítico para os automoveis foi, para evitar fortes emissões de óxidos de azoto. Nós emitimos demasiado destes óxidos em processos de combustão, especialmente em automoveis, e perturbamos o equilíbrio no ar.
O óxido nitroso N2O é formado por exemplo pela bactéria nos chamados processos de degradação. A microbiologia de tais pequenos organismos vivos desempenham um papel muito importante no ciclo do azoto. Mas N2O não reage na troposfera. Vai directamente para a estratosfera, onde é dividido pela radiação solar (processo de fotólise).
O amoníaco NH3 é o gás base mais importante. Proveniente por exemplo dos animais existentes em quintas de cultivo e da fertilização, mas também da degradação microbiologica (bactérias), pode dar forma a partículas de sal de NH4NO3 juntamente com o ácido nítrico.
|
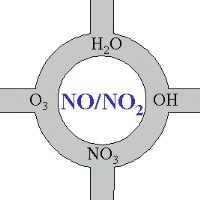
Os óxidos de azoto nos cruzamentos da química da atmosfera
Mesmo se não tivermos um olhar próximo da química do óxido de azoto, podemos manter na mente, que estes compostos são, pelo menos um bocadinho, o coração da química da atmosfera. Uma parte principal dos compostos químicos, que são oxidados e removidos da atmosfera ou transformados em outros compostos estão relacionados directa ou indirectamente com NO ou NO2.
|
 |
 |
 |
|
4. Óxidos de azoto - no centro da química da atmosfera
imagem: Elmar Uherek
|
|
|
Páginas relacionadas:
Os radicais de nitrato possuem um importante papel à noite. Leia mais acerca deste assunto em:
Baixa atmosfera - Mais - Unidade 1 - Noite e nitratos
Poderá encontrar mais informação acerca da química dos óxidos de azoto no buraco de azono em:
Alta atmosfera - Mais - Unidade 2 - Químmica do cloro
|
About this page:
author: Dr. Elmar Uherek - MPI for Chemistry, Mainz
scientific reviewing: Dr. Rolf von Kuhlmann, MPI for Chemistry, Mainz
educational proofreading: Michael Seesing - Uni Duisburg - 2003-07-02
revised and last published: 2004-04-30
|
|
 |
|







