|
|
 |
|
|
|
 |
| |
|
|
 |
Les Océans
Bases |
L'eau et ses caractéristiques étonnantes
71% de la planète sont recouverts d'eau et 97% de cette eau se trouve dans les océans. L'eau auest constituée de deux atomes d'hydrogène et d'un atome d'oxygène. A l'intérieur de la molécule d'eau, l'atome d'oxygène a une légère charge négative tandis les atomes d'hydrogène sont légèrement positifs. Quand les molécules d'eau sont très proches les unes des autres, les zones positives et les zones négatives s'attirent. C'est parce que ces forces d'attraction existent que l'eau a des caractéristiques très particulières, qui rendent la vie sur terre possible.
|
 |
 |
|
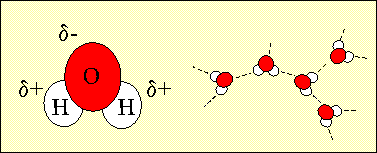
1. La structure de l'eau, qui montre la charge légèrement négative de l'atome d'oxygène, et la charge légèrement positive des atomes d'hydrogène. Le fait que la molécule d'eau ait ainsi des charges lui permet de créer des liaisons avec les autres molécules d'eau qui l'entourent (à droite du dessin). Auteur: Lucinda Spokes.
|
|
|
|
|
 |
- L'eau est la seule substance qui peut exister naturellement à l'état de gaz (vapeur d'eau), à l'état liquide et à l'état solide (glace).
|
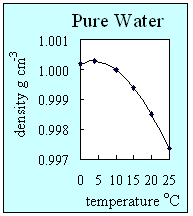
- La densité permet de mesurer si une substance est plus ou moins compacte. Elle est définie comme la masse d'une substance divisée par son volume. La forme la plus dense d'une substance est généralement l'état solide, puis c'est la forme liquide puis la forme gazeuse, qui elle est la moins dense. Généralement lorsque la température augmente, la densité diminue. L'eau pure est une exception: c'est la seule substance qui est plus dense lorsqu'elle est a liquide que lorsqu'elle est solide. C'est à 4°C que l'eau est la plus dense. A basse température, l'eau liquide est plus dense que la glace et ceci signifie que la glace flotte.
|
 |
 |
 |
|
2. Evolution de la densité de l'eau pure avec la température. On peut voir sur ce graphe que l'eau pure a sa densité maximale à 4 oC , alors qu'elle est encore liquide. Auteur: Lucinda Spokes.
|
|
 |
 |
|
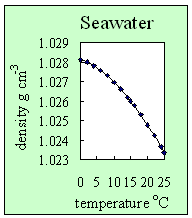
3. Evolution de la densité de l'eau de mer avec la température. Pour une quantité de sel dans l'eau donnée (dans ce cas la salinité est de 35, ce qui signifie qu'il y a 35 grammes de sel par litre d'eau de mer), la densité de l'eau de mer diminue avec la température. Auteur: Lucinda Spokes.
|
|
 |
- En ajoutant du sel à l'eau, on augmente sa densité. Le sel limite également la formation des liaisons hydrogène entre plusieurs molécules d'eau. Ceci signifie que l'eau de mer, à la différence de l'eau pure, n'a pas sa densité maximum à 4°C, mais plutôt lorsqu'elle se transforme en glace. Ceci implique aussi que l'eau de mer gèle en-dessous de 0°C (c'est d'ailleurs pour cela que nous mettons du sel sur les routes avant une nuit froide, pour éviter le risque de formation de glace).
|
- L'eau a une capacité thermique très élevée. Ceci signifie qu'il faut fournir beaucoup d'énergie pour faire augmenter sa température. La Terre étant composée d'eau à 71%, l'énergie du soleil ne fait pas beaucoup changer la température de la planète. C'est grâce à cela que la Terre ne devient ni trop chaude ni trop froide lorsque l'ensoleillement varie au cours des mois et des années, et que la vie a pu être possible. La chaleur est stockée par l'océan en été et rendue à l'atmosphère en hiver. Les océans permettenet ainsi de tempérer le climat en réduisant les différences de la température entre les saisons.
|
 |
 |
 |
|
4. Il faut 4 fois plus d'énergie pour chauffer de l'eau que pour chauffer la même quantité d'air. Auteur: Lucinda Spokes.
|
|
- L'eau a également une chaleur de vaporisation élevée. Cela veut dire qu'il faut beaucoup d'énergie solaire pour transformer l'eau liquide en vapeur. Lorsque la vapeur d'eau se déplace de régions chaudes vers des régions plus froides, elle redevient liquide et peut alors donner des nuages et de la pluie. Ceci libère de la chaleur, qui réchauffe l'air. L'énorme quantité d'énergie qui avait servi à la vaporisation et qui est ainsi libérée lorsque l'eau redevient liquide sert aux orages et aux vents.
- Beaucoup de substances se dissolvent dans l'eau et sont y stabilisées par les liaisons hydrogène. Ceci permet le transport de l'oxygène, du dioxyde de carbone, des nutriments et des déchets dans l'eau, rendant ainsi les processus biologiques possibles.
- Les molécules d'huile sont grandes et ne sont pas électriquement chargées, elles ne peuvent donc pas être cassées en plus petites molécules chargées : elles ne sont pas stabilisées par l'eau comme le peuvent l'être d'autres substances. C'est pour cette raison que les corps gras, comme l'huile ou le pétrole, ne se dissolvent pas dans l'eau.
|
 |
 |
|
5. Photo des vagues s'écrasant sur le bateau: Wendy Broadgate. Autres images de la NOAA.
|
|
A propos de cette page:
auteur: Lucinda Spokes - Environmental Sciences, University of East Anglia, Norwich - U.K.
dernière version: 2003-12-10
|
|
 |
|







