|
|
 |
|
|
|
 |
| |
|
|
 |
Oceanos
Básico |
Propriedades específicas da água
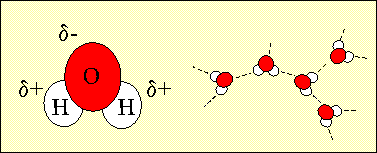
71% da superfície da Terra encontra-se coberta de água e, desta, 97% são águas oceânicas. A molécula de água é constituída por dois átomos de hidrogénio e um átomo de oxigénio. Na molécula de água, e por causa da sua estrutura electrónica, o átomo de oxigénio apresenta-se com uma pequena carga negativa enquanto que o átomo de hidrogénio apresenta-se com uma carga ligeiramente positiva. Quando as moléculas de água são muito próximas, estas regiões moleculares positiva e negativa atraem-se. Estas forças atractivas são conhecidas por ligações de hidrogénio e representam a razão principal pela qual a água apresenta propriedades muito particulares que tornam possível a vida na Terra.
|
 |
 |
|
1. A estrutura da água apresentando a pequena carga negativa do átomo de oxigénio e a pequena carga positiva dos átomos de hidrogénio. Estas pequenas cargas da molécula de água possibilita, através das ligações de hidrogénio, associar-se a outras moléculas de água. Autor: Lucinda Spokes.
|
|
|
|
|
 |
- A água é a única substância natural que pode ser encontrada, na Terra, na sua forma gasosa (vapor de água), líquida e sólida (gelo).
|
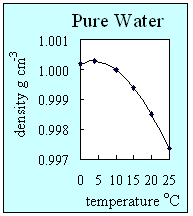
- A massa volúmica de uma substância mede o grau de compacidade desta substância. Define-se pela razão entre a massa da substância e o seu volume. Os sólidos são, geralmente, mais compactos que os líquidos e os gases. Com o aumento da temperatura da substância, a sua massa volúmica decresce, em geral. A água pura é uma excepção a esta regra. De facto, a água é a única substância que apresenta uma massa volúmica maior quando se encontra no seu estado líquido. O seu valor máximo obtém-se a 4 oC. Esta particularidade da água pura deve-se às ligações de hidrogénio existentes entre as suas moléculas, que na fase sólida (gelo) formam uma estrutura ordenada, aberta e muito estável. Com baixas temperaturas, a água, na fase líquida, apresenta uma massa volúmica mais alta que na fase sólida. É, por isso, que o gelo flutua na água líquida.
|
 |
 |
 |
|
2. Como a massa volúmica da água pura varia com a variação da temperatura. Esta figura mostra que a água pura tem maior massa volúmica a 4oC quando se encontra na fase líquida. Autor: Lucinda Spokes.
|
|
 |
 |
|
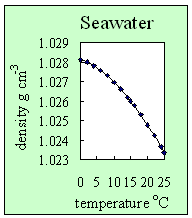
3. Como a massa volúmica da água do mar varia com a variação da temperatura. Com um valor fixo da concentração do sal (neste caso a salinidade é de 35) a massa volúmica decresce com o aumento da temperatura. Autor: Lucinda Spokes.
|
|
 |
- Quando se adiciona sal à água pura a sua massa volúmica aumenta, o que impede a formação das ligações de hidrogénio. A massa volúmica da água do mar, ao contrário da água pura, não apresenta o seu máximo aos 4 oC, mas quando esta se encontra no seu estado sólido (gelo). A água do mar congela abaixo do 0 oC (é por este motivo que se coloca o sal na estrada durante as noites frias para minimizar o risco de formação de gelo).
|
- A água possui um valor alto da capacidade do calor específico. O calor específico corresponde à energia necessária para aumentar a temperatura da substância de 1ºC. Como 71 % da superfície do globo é coberta por água, a energia de origem solar causa, apenas, pequenas alterações na temperatura do planeta. Assim, os oceanos controlam o aquecimento ou o arrefecimento do planeta e proporcionam todas as condições fundamentais para tornar possível a vida na Terra. O calor é armazenado pelos oceanos durante o verão e é libertado de volta para a atmosfera no inverno. Assim, os oceanos moderam o clima através da redução das diferenças de temperatura entre as estações do ano.
|
 |
 |
 |
|
4. A água, comparada com o ar, necessita de quatro vezes mais energia para aquecer 1ºC. Autor: Lucinda Spokes.
|
|
- A água apresenta um valor alto do calor latente de vaporização. Assim, a maior parte da energia solar, incidente sobre os oceanos, é utilizada para transformar a água líquida em vapor (processo de vaporização). Quando o vapor de água se movimenta das regiões quentes para as regiões frias, na atmosfera, muda o seu estado, de volta para o líquido e pode formar chuva. Esta libertação de calor aquece o ar. As enormes quantidades de energia envolvida pode potenciar tempestades e ventos na atmosfera terrestre.
- Muitas substâncias se dissolvem na água e tornam-se estáveis devido às ligações de hidrogénio. Isto permite o transporte, por exemplo, do oxigénio, do dióxido de carbono, de nutrientes e resíduos, suspensos na água, e torna possível os processos biológicos.
- Como as moléculas de petróleo são demasiadamente grandes e electricamente neutras, não podem ser divididas em pequenas moléculas carregadas e, por consequência, não se fixam pelas moléculas de água. É por esta razão que o petróleo não se dissolve na água.
|
 |
 |
|
5. Fotografia das ondas quebrando-se sobre o navio de investigação científica, tirada por Wendy Broadgate. Outras fotografias cedidas pela NOAA.
|
|
About this page:
author: Lucinda Spokes - Environmental Sciences, University of East Anglia, Norwich - U.K.
1. sci. reviewer:
2. sci. reviewer:
edu. reviewer:
last updated: 2003-12-10
|
|
 |
|







