|
|
 |
|
|
|
 |
| |
|
|
 |
Untere Atmosphäre
Mehr |
Messtechniken - Spektroskopie
Die meisten Spurengase in der Atmosphäre sind in Konzentrationen von weniger als einem millionstel Anteil vorhanden. Woher wissen wir die genauen Konzentrationen? Welche Messtechniken werden für gewöhnlich genutzt?
|
|
|
|
|
 |
|
Für die Analyse von Luft, sei es von Luftproben im Labor oder direkt draußen, werden zwei Techniken sehr oft genutzt:
a) Spektroskopie - Sie basiert auf den Wechselwirkungen von Molekülen mit Licht unterschiedlicher Energie.
b) Chromatographie - Sie basiert auf der Wechselwirkung von Molekülen mit anderen Molekülen.
|
 |
 |
|
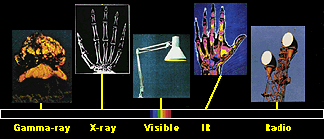
1. Das elektromagnetische Spektrum besteht aus verschiedenen Arten von elektromagnetischen Wellen verschiedener Energie, z.B. Gammastrahlung, Röntgenstrahlung (X-ray), sichtbares Licht (visible), Infrarotlicht (IR) und Radiowellen. Viele von ihnen können uns dabei helfen, die Eigenschaften und Konzentration von Molekülen in der Luft zu untersuchen.
Quelle und weitere Informationen zum elektromagnetischen Spektrum:  NASA NASA
|
|
 |
Die Eigenschaften von Strahlung
Aus unserer Alltagserfahrung im Umgang mit Radios und Mikrowellen oder von Sonnenbänken und Röntgenuntersuchungen wissen wir, dass es eine Menge verschiedener elektromagnetischer Wellen gibt, die auch Energie durch die Luft transportieren. Sie alle zusammen bilden das elektromagnetische Spektrum. Ihre Energien sind verschieden und nur ein kleiner Bruchteil von ihnen ist sichtbar. Diesen bezeichnen wir als sichtbares Licht und es erhellt unseren Tag. Die Energie dieser Wellen nimmt in der Reihenfolge Radiowellen, Mikrowellen, Infrarotlicht, sichtbares Licht, UV-Licht, Röntgenstrahlung zu. Je kürzer die Wellenlänge, desto höher sind die Frequenz und die Energie. Nahezu alle diese Wellen wechselwirken mit den Molekülen in der Luft und aus der Art und Weise, wie sie dies tun, kann geschlossen werden, um welche Moleküle es sich handelt.
|
Wellenlänge, Frequenz und Energie verschiedener Regionen im elektromagnetischen Spektrum:
|
|
Wellenlänge (m) |
Frequenz (Hz = s-1) |
Energie (J) |
|
Radio |
> 1 x 10-1 |
< 3 x 109 |
< 2 x 10-24 |
|
Mikrowelle |
1 x 10-3 - 1 x 10-1 |
3 x 109 - 3 x 1011 |
2 x 10-24- 2 x 10-22 |
|
Infrarot |
7 x 10-7 - 1 x 10-3 |
3 x 1011 - 4 x 1014 |
2 x 10-22 - 3 x 10-19 |
|
Sichtbares Licht |
4 x 10-7 - 7 x 10-7 |
4 x 1014 - 7.5 x 1014 |
3 x 10-19 - 5 x 10-19 |
|
Ultraviolett |
1 x 10-8 - 4 x 10-7 |
7.5 x 1014 - 3 x 1016 |
5 x 10-19 - 2 x 10-17 |
|
Röntgen |
1 x 10-11 - 1 x 10-8 |
3 x 1016 - 3 x 1019 |
2 x 10-17 - 2 x 10-14 |
|
Gammastrahlung |
< 1 x 10-11 |
> 3 x 1019 |
> 2 x 10-14 |
|
Wechselwirkung von Licht und Molekülen
Trifft eine Welle auf ein Molekül in der Luft, so kann sie ihre Energie auf das Molekül übertragen und seinen Zustand ändern. Ein Molekül zur Rotation zu bringen, erfordert weniger Energie, als seine Bindungen zu einer Schwingung anzuregen. Noch mehr Energie ist notwendig, um ein Elektron auf eine andere Bahn um den Atomkern anzuregen. Diese Anregungsenergien (Rotations-, Schwingungs-, Elektronenanregung) sind charakteristisch für eine Molekülsorte. Daher können wir beobachten, dass ein bestimmter Teil der Strahlung absorbiert wird (verloren geht), wenn wir sichtbares Licht, Infrot- oder UV-Licht oder andere Wellen durch Luft schicken. Aus den Eigenschaften des Lichtes, welches absorbiert wird (Wellenlänge und Intensität), können wir auf Art und Konzentration der Substanzen (Moleküle) schließen, welche das Licht aufnehmen.
|
|
|
 |
Nehmen wir an, wir emittieren Wellen von einer Infrarotlicht-Quelle (S). Das Licht habe verschiedene Energie (E) und der Strahl gehe durch ein Luftpaket. Wir messen den Lichtanteil, der am Detektor (D) ankommt. Die verschiedenen Energien (= verschiedenen Wellenlängen) sind in verschiedenen Rottönen dargestellt.
|
|
|
 |
Ein bestimmtes Molekül absorbiert Licht bestimmter Energie (zwei von den sechs verschiedenen Energien werden geblockt). Das Licht erreicht den Detektor nicht mehr. Subtrahiert man nun das Originalspektrum ohne Molekül von dem Spektrum mit Molekül, so erscheint ein Absorptionspeak, der rechts gezeigt ist. Dieser Peak steht für den gemessenen Lichtverlust. Je höher er wird, desto mehr Licht wurde absorbiert (siehe Abb. 2 d).
|
 |
 |
|
2. a-c) Animationen: Elmar Uherek
Bitte zum Vergrößern anklicken! (30 K)
|
|
 |
Nehmen wir nun ein anderes Molekül, das Licht absorbiert. Aber mehr Energie ist erforderlich, um die Bindungen zum Schwingen anzuregen. Der Absorptionspeak erscheint an einer anderen Stelle des Spektrums.
|
 |
 |
|
Anders als in den drei Bildern zuvor, betrachten wir nun einen ganz kleinen Energiebereich (alle Pfeile haben dieselbe Farbe = fast dieselbe Energie), z.B. die Absorptionsenergie des ersten Moleküls. Die Schwächung der Farbe am Detektor sagt uns, dass umso weniger Licht am Detektor ankommt, je mehr Moleküle sich im Lichtweg befinden. Die Höhe der Absorptionsbande wächst. (Es ist eine negative Bande, die wächst, wenn weniger Licht ankommt.)
Bitte zum Vergrößern anklicken!
|
|
 |
Aus dem Spektrum erhalten wir nicht nur die Information, welche Moleküle in der Luft sind (Position der Absorptionsbanden). Aus der Intensität der Banden erfahren wir auch, wie viele Moleküle es sind, da die Aufnahme des Lichtes proportional zur Zahl der Moleküle ist.
|
Messung der Lichtabsorption
In der Atmosphäre gibt es verschiedene Möglichkeiten, die Absorption von Licht zu messen. Auf der Erde kann die Absorption des Lichtes von Sonne oder Mond gemessen werden (UV und sichtbares Licht). Satelliten messen das Licht, das von der Erde kommt, oder Sonnenlicht, das an der Erde und den Wolken reflektiert wird bzw. tangential zur Erdoberfläche verläuft.
|
 |
 |
 |
|
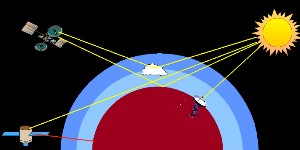
3. Auf Satelliten basierende Messungen der Absorption in der Atmosphäre
Bild: Elmar Uherek
Bitte zum Vergrößern anklicken!
|
|
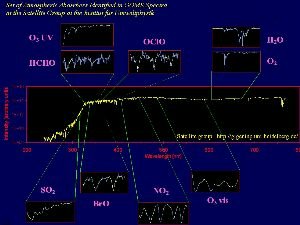
Nicht nur die Infrarotstrahlung der Erde (Oberflächentemperatur) wird durch Satelliten gemessen. Viele wichtige anorganische Gase wie Ozon und Stickoxide, aber auch Halogenoxide können vom Weltraum aus beobachtet werden. Ein Beispiel ist das Global Ozone Monitoring Experiment (GOME). Nicht nur Ozon wird hier gemessen, sondern auch NO2, Wasser, SO2 und Formaldehyd (HCHO). Das GOME Instrument befindet sich an Bord des Satelliten ERS-2 und nimmt Spektren im ultravioletten und sichtbaren Bereich sowie im nahen Infrarot (240-790 nm) auf.
|
 |
 |
 |
|
4. Von Satelliten gemessene Spektren anorganischer Verbindungen in der Atmosphäre, aufgezeichnet vom GOME Instrument.
Quelle: Satellitengruppe IUP Heidelberg
Bitte zum Vergrößern anklicken! (150 K)
|
|
 |
 |
|
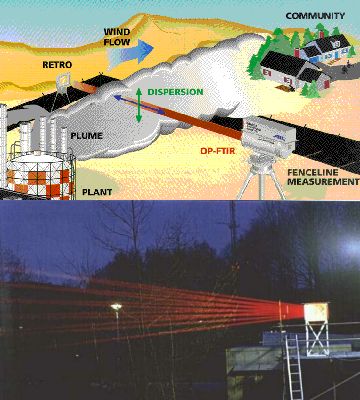
5. a+b)´Bitte beachten: Infrarotes Licht ist nicht sichtbar. Hier können die Strahlen nur gesehen werden, da ein Teil des Lichtes auch im roten Teil des sichtbaren Spektrums emittiert wird.
|
|
 |
Natürlich können auch beide, Lichtquelle und Detektor, auf der Erde installiert werden. Da sie jedoch nicht zu weit voneinander weg aufgestellt werden müssen und da die Konzentrationen sehr gering sind, werden komplizierte Spiegeltechniken benutzt, um durch mehrmalige Reflektion den Lichtweg durch die Luft lang zu machen (so genannte White-Zellen). Das Bild links zeigt einen solchen Aufbau in der Theorie (Bild aus: EPA Field Analytik Technology Enyclopaedia) und darunter in der Praxis (Foto: FZ Jülich). Hier wird Infrarotlicht genutzt. Ein einfaches Beispiel für ein Spektrum ist unten gezeigt.
|
 |
 |
|
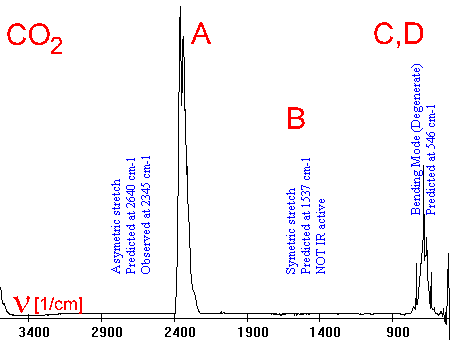
6. Ein einfaches Beispiel für Infrarotspektren ist das von Kohlendioxid (CO2), hier dargestellt zusammen mit den aktivierten Schwingungen. Infrarotspektren können recht kompliziert sein, wenn Absorptionen verschiedener Moleküle überlappen oder auch wenn die Moleküle selbst komplex sind und verschiedenste Schwingungen angeregt werden können (rechts die Schwingungen des CO2).
Spektrum und Animation von: Scott Van Bramer,  Widener University Widener University
|
|
 |
Schwingungen:
A Asymmetrische Streckschwingung

B Symmetrische Streckschwingung
[nicht IR-aktiv]

C vertikale Biegeschwingung

D horizontale Biegeschwingung

|
Verwandte Seiten:
Interessieren dich die Eigenschaften von Licht, dann wirf auch einen Blick auf:
Wolken und Partikel - Basis - Einheit 3 - Regenbogen
Mehr über Verfahren, wie die Atmosphäre beobachtet werden kann in:
Obere Atmosphäre - Basis - Einheit 1 - Messtechniken
|
About this page:
author: Dr. Elmar Uherek - MPI for Chemistry, Mainz
scientific reviewer: Dr. Mark Lawrence - MPI for Chemistry, Mainz - 2004-05-05
educational proofreading: Michael Seesing - Univ. of Duisburg - 2003-07-02
Letzte Überarbeitung: 2007-08-20 | |
|
 |
|







