|
|
 |
|
|
|
 |
| |
|
|
 |
Untere Atmosphäre
Mehr |
Oxidation in der Atmosphäre
Viele chemische Verbindungen werden in die Atmosphäre entlassen. Sie würden sich dort ansammeln, gäbe es nicht auch Wege, sie wieder zu entfernen. Dies kann durch trockene Ablagerung (trockene Deposition) oder durch Auswaschen mit dem Regen geschehen. Besonders bei organischen Verbindungen ist das Entfernen einfacher, wenn sie vorher in einen weniger flüchtigen, wasserlöslichen Zustand oxidiert wurden ...
|
|
|
|
|
 |
 |
 |
|
1. OH reinigt die Luft
Bild: Elmar Uherek
|
|
 |
Oxidation im chemischen Sinne muss nicht immer bedeuten, dass eine Reaktion mit Sauerstoff enthaltenden Verbindungen stattfindet. In der Luft allerdings ist Sauerstoff fast immer mit von der Partie. Drei wichtige Oxidationsmittel bestimmen die Prozesse in der Atmosphäre:
das Hydroxyl-Radikal OH
das Nitrat-Radikal NO3
das Ozonmolekül O3
Auch Hydroperoxy-Radikale HO2 sind wichtig und manchmal fasst man die Summe von OH und HO2 als HOx zusammen. Das wichtigste Oxidationsmittel jedoch ist das OH-Radikal. Es ist sehr reaktiv und in der Lage, die meisten chemischen Verbindungen in der Troposphäre zu oxidieren.
Darum wird es auch das 'Waschmittel der Atmosphäre' genannt.
|
Nur wenige Substanzen wie die Fluorchlorkohlenwasserstoffe FCKW (zum Beispiel CF2Cl2) oder Distickstoffmonoxid N2O oder Kohlendioxid CO2 sind sehr stabil und reagieren nicht oder nur sehr langsam mit OH. Auch die Reaktionsgeschwindigkeit von Methan CH4 ist 100-1000 mal langsamer, als die der meisten anderen organischen Verbindungen. Dies erklärt, dass die Methankonzentration in der Luft (etwa 1,77 ppm = 1,77 µmol/mol*) relativ hoch ist. Die meisten anderen organischen Gase dagegen sind nur mit einer Konzentration von unter einem milliardstel Anteil, also unter 1 ppb (1 nmol/mol*), vertreten.
|
 |
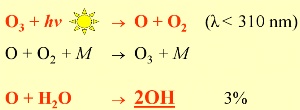 |
 |
|
2. Bildung von OH: > 97% der O-Atome, die bei der Lichtspaltung (Photolyse) von Ozon gebildet werden, reagieren auch wieder zu Ozon zurück. Weniger als 3% aber führen zur Bildung des wichtigsten Radikals in der Atmosphäre: OH.
Wenn zwei Moleküle oder Atome A und B kollidieren und ein drittes Molekül C bilden, dann ist immer ein dritter Partner M notwendig, der die überschüssige Energie aufnimmt. Dieser Partner – in den meisten Fällen ist es Stickstoff – reagiert aber selbst nicht.
Bitte zum Vergrößern anklicken!
|
|
 |
 |
|
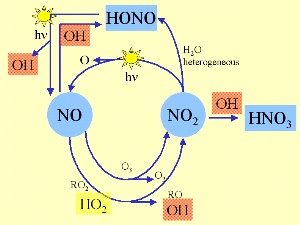
3. OH und der Stickoxidzyklus
Schema von Elmar Uherek
Bitte zum Vergrößern anklicken! (90 K)
|
|
 |
Wie wird OH gebildet?
OH bestimmt die atmosphärische Chemie vor allem während des Tages, denn seine Bildung hängt von der Sonnenstrahlung ab. Die auslösende Reaktion (siehe oben) ist die Spaltung von Ozon durch Sonnenlicht (Photolyse), die Licht einer Wellenlänge von weniger als 310 nm erfordert. Es folgt eine Reaktion des hierbei gebildeten O-Atoms mit Wasser. Aus diesem Grund ist eine geringe Menge an Ozon in der Troposphäre notwendig, auch wenn zu viel schädlich ist.
Andere Quellen für OH sind die Photolyse von salpetriger Säure HONO (auch HNO2 geschrieben), Wasserstoffperoxid H2O2 oder Peroxymethan CH3OOH, die Reaktion von Stickstoffmonoxid NO mit dem Hydroperoxyl-Radikal HO2 oder die Reaktion von Alkenen mit Ozon. Das Schema zur Linken zeigt, in welcher Weise OH am Tage mit den Reaktionszyklen der Stickoxide verknüpft ist.
|
Wieviel OH wird gebildet?
Da OH ein extrem reaktives Radikal ist, reagiert es sofort wieder ab, sobald es gebildet wird. Seine Lebensdauer liegt bei einer Sekunde oder weniger. Daher ist die mittlere Konzentration in der Luft sehr gering, im Bereich von 1x105 bis 2x107 Moleküle cm-3. Dies entspricht für den Luftdruck auf Meereshöhe einem Mischungsverhältnis von 0,01 - 1 ppt (pmol/mol). Von 1000 - 100.000 Milliarden Teilchen in der Luft ist nur eines OH.
Da die Bildung vom Wasserdampf abhängt, sinkt die OH-Konzentration mit der Höhe (die Luft ist kühler und trockener).
|
 |
 |
 |
|
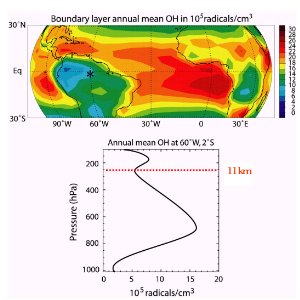
4. Verteilung von OH
In etwa 11 km Höhe wird ein Druck von 250 hPa erreicht (Höhe der Tropopause in mittleren Breiten). Welchen Höhen entsprechen 1000, 800, 600 und 400 Hektopascal? Benutze die Beziehung zwischen Druck und Höhe!
Quelle: Präsentation J. Lelieveld - MPI Mainz 2003
Bitte zum Vergrößern anklicken! (80 K)
|
|
In besonderem Maße nimmt die Konzentration aber auch mit der geographischen Breite ab, nicht nur auf Grund der sinkenden Wasserdampfkonzentration, sondern auch, weil die Intensität des Sonnenlichtes und die Sonnenscheindauer in Richtung der Pole abnehmen.
Wie reagiert OH?
Das Bild rechts zeigt einen interessanten Effekt über dem tropischen Regenwald. Die OH-Konzentration sinkt in der Nähe des Bodens. Was ist der Grund? Viele organische Verbindungen, vor allem Isopren, werden vom Wald emittiert und reagieren mit OH. Daher wird OH in Bodennähe verstärkt in chemischen Reaktionen verbraucht. OH neigt dazu, wenn immer möglich, die H-Atome von einer organischen Verbindung RH abzuspalten und Wasser H2O zu bilden. Im nächsten Schritt reagiert das Radikal R mit Sauerstoff und bildet organische Peroxide. Diese sind z.B. bei der Bildung troposphärischen Ozons wichtig. mit Sauerstoff und bildet organische Peroxide. Diese sind z.B. bei der Bildung troposphärischen Ozons wichtig.
|
 |
 |
 |
|
5. OH Verteilung in den Tropen
oben: die globale Verteilung in den tropischen Regionen
darunter: Höhenprofil über der Station im Regenwald von Manaus (Brasilien)
Quelle: Vortrag J. Lelieveld MPI Mainz 2003
Bitte zum Vergrößern anklicken! (80 K)
|
|
|
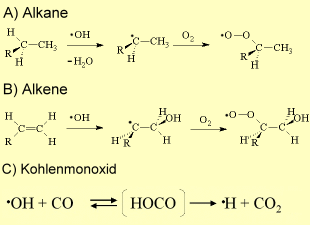
Nun reagiert weltweit gesehen OH aber nicht vor allem mit organischen Verbindungen aus Wäldern. Größere organische Verbindungen tragen nur zu etwa 30% zum OH Abbau bei, weitere 15% alleine das Methan, das wichtigste und kleinste organische Molekül. Das Gas, was jedoch hauptsächlich mit OH reagiert, ist Kohlenmonoxid (40% Anteil). Die verbleibenden 15% tragen Ozon O3, Hydroperoxy-Radikale HO2 und Wasserstoff H2 bei.
|
 |
 |
|
6. Wichtige OH-Reaktionen in der Troposphäre
Bitte zum Vergrößern anklicken! (45 K)
|
|
 |
In der Reaktion mit kleinen Alkenen neigt OH dazu, sich an die Doppelbindung anzulagern, solange der gesättigte Rest nicht viel größer ist und die Abspaltung eines H-Atoms statistisch begünstigt ist. Auch in der Alkenreaktion werden Peroxide gebildet.
OH ist in der Lage, Kohlenmonoxid CO zu Kohlendioxid CO2 zu oxidieren. Wie erwähnt sind CO und Methan die bedeutendsten Senken für OH. Andere organische Substanzen sind nur in Spuren von einigen ppt vorhanden. CO hingegen erreicht Konzentrationen von 120 ppb auf der Nordhalbkugel (mehr Verbrennungsprozesse) und 60 ppb auf der Südhalbkugel.
|
Wenngleich OH das wichtigste Oxidationsmittel in der Atmosphäre ist, sind die Konzentrationen nachts nahezu null, da die Bildung Sonnenstrahlung erfordert. Darum wird in der Dunkelheit der Nacht die Chemie von Nitrat-Radikalen NO3 und auch Ozon O3 wichtiger.
|
 |
 |
 |
|
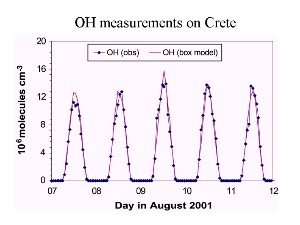
7. Zeitprofil der OH-Konzentration über mehrere Tage.
Quelle: Vortrag J. Lelieveld MPI Mainz 2003
|
|
* Das Mischungsverhältnis in ppb oder ppm (= 1 Molekül unter 1 Milliarde Moleküle, bzw. 1 Molekül unter einer Million Moleküle) wird oft in wissenschaftlichen Veröffentlichungen sowie in der Literatur und Meldungen zu Atmosphäre und Klima verwandt. Wir nutzen es auch hier in der Klimaenzyklopädie. Korrekter müsste man es jedoch in der Einheit 1 nmol/mol (= 1 ppb) oder 1 µmol/mol (= 1 ppm) schreiben. Denn eine Anzahl von Molekülen n wird in der Einheit mol angegeben.
|
About this page:
author: Dr. Elmar Uherek - MPI for chemistry, Mainz
scientific reviewer: Dr. Mark Lawrence - MPI for chemistry, Mainz 2004-05-05
educational proofreading: Michael Seesing - Uni Duisburg - 2003-07-02
Letzte Überarbeitung: 2007-08-21 | |
|
 |
|







