|
|
 |
|
|
|
 |
| |
|
|
 |
Alta Atmosfera
Principi |
Clorofluorocarburi (CFC) e il buco dell'ozono
La storia del buco dell'ozono è un esempio efficace di come una classe di composti chimici apparentemente innocua possa diventare un pericolo reale per la vita sulla terra. Ma dimostra anche come i governi, l’industria e la società possano lavorare insieme per identificare un problema ambientale e risolverlo con successo.
|
|
|
|
|
 |
|
Il buco dell'ozono ci ha insegnato che le azioni degli uomini possono cambiare lo stato naturale del clima in maniera imprevedibile. Ci ha anche mostrato che, se la comunità mondiale lavora insieme focalizzandosi su di una tematica, i problemi ambientali globali possono essere gestiti efficacemente. I CFC sono solo una delle classi di composti chimici in grado di danneggiare lo strato di ozono, ma sono i più importanti.
|
Le proprietà dei CFC e il loro utilizzo
I clorofluorocarburi sono composti organici semplici in cui tutti gli atomi di idrogeno sono stati sostituiti dagli alogeni cloro e fluoro (e.g. CFC-11 CFCl3 and CFC-12 CF2Cl2). In commercio sono conosciuti come FREON. I CFC sono stati utilizzati come refrigeranti, come solventi nell'industria elettronica, come propellenti degli aerosol, negli estintori, come solventi per la pulizia a secco, come agenti sgrassanti e come espandenti negli imballaggi di polistirolo e nei materiali isolanti.
I CFC sono stati utilizzati estensivamente perché finché rimangono nella troposfera, non sono assolutamente reattivi e non recano in alcun modo danno alla salute dell'uomo. Questa inerzia conferisce loro un'emivita atmosferica estremamente lunga e permette loro di accumularsi nell'atmosfera. La caratteristica nociva che non era stata inizialmente presa in considerazione consiste nel fatto che questi composti vengono distrutti dalla radiazione ultravioletta estremamente energetica proveniente dal sole.
|
 |
 |
 |
|
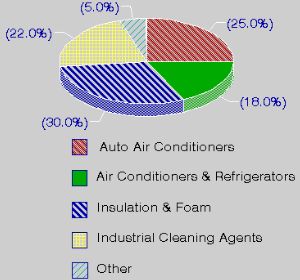
1. Utilizzo di CFC. Informazioni dal US Environmental Protection Agency.
|
|
|
Sviluppi attuali sul mercato
La produzione di CFC è ora proibita in quasi tutto il mondo. Sono stati sostituiti da idrocarburi parzialmente alogenati (HFC e HCFC*) e altri composti. Ma anche gli HCFC contribuiscono (in parte minore) alla deplezione dell'ozono. Gli HFC così come gli HCFC sono gas serra. Inoltre, molti CFC circolano ancora in macchinari che sono tuttora in uso o non ancora smantellati. Perciò, è piuttosto complesso prevedere le quantità di CFC che verranno rilasciate in atmosfera nei prossimi anni.
* HFC = idrofluorocarburi, HCFC = idroclorofluorocarburi
|
 |
 |
|
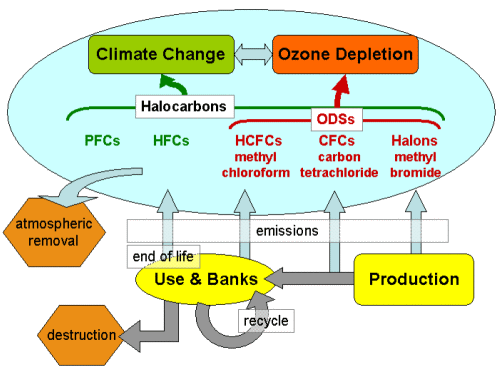
2. Diagramma di flusso dei composti alogenati e loro impatti sull'effetto serra e sul buco dell'ozono. Fonte: IPCC/TEAP 2005 fig. SPM-1
|
Poiché le riserve di CFC si ridurranno negli anni a venire, il pericolo per lo strato di ozono è destinato a diminuire. Ma rimane il problema degli effetti sul clima. I sostituti dei CFC, infatti, mantengono valori elevati di potenziale di riscaldamento globale e la domanda di impianti di condizionamento per le auto e le abitazioni sta aumentando.
|
 |
 |
 |
|
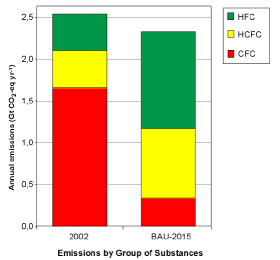
3. Le emissioni di composti alogenati si sposteranno dai CFC ai loro sostituti seguendo l’andamento attuale (scenario "business-as-usual"). Fonte: IPCC/TEAP 2005 fig. SPM-4
|
|
 |
 |
|
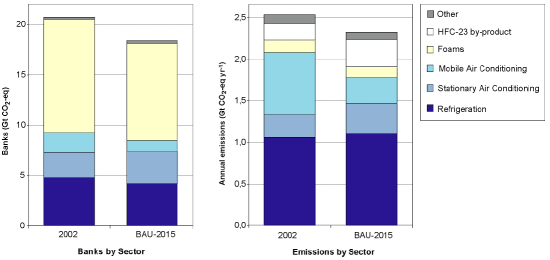
4. Stoccaggio ed emissioni annuali di composti alogenate divisi per settori. Le principali applicazioni sono i condizionatori d'aria e la refrigerazione. Le emissioni sono espresse in CO2-equivalenti, cioè sono convertite nella quantità di CO2 che ha lo stesso impatto sul riscaldamento del pianeta. Per un confronto: le emissioni annuali di CO2 delle attività umane sono circa 7 GtC.
Fonte: IPCC/TEAP 2005 fig. SPM-4
|
 |
 |
|
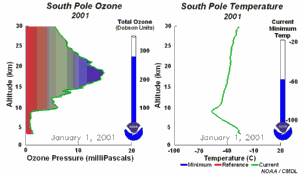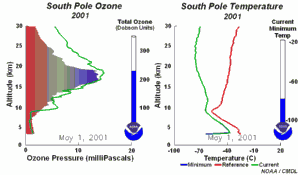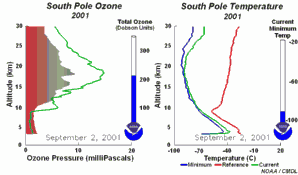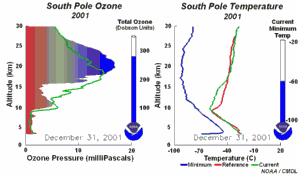
2. Lo sviluppo del buco dell'ozono nel 2001. Cliccare per allargare una sequenza di 5 giorni (270 K)! Animazione originale fornita dal NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado.
|
|
 |
Il destino stratosferico dei CFC
La radiazione ultravioletta altamente energetica proveniente dal sole è assorbita dall'ozono stratosferico e, di conseguenza, non penetra nella troposfera. Questo significa che la luce ultravioletta che raggiunge la superficie terrestre è troppo debole per distruggere i CFC ivi presenti. Tuttavia, siccome i CFC hanno un'emivita atmosferica così lunga, delle quantità significative riescono a raggiungere la stratosfera dove la radiazione ultravioletta è abbastanza forte da scinderli nei radicali cloro e fluoro che sono molto reattivi. Questi radicali sono in grado di distruggere l'ozono.
|
|
Questo processo, tuttavia, non porta necessariamente ad una forte deplezione dell'ozono perché i radicali cloro (i principali responsabili per la rimozione dell'ozono) subiscono anche altre reazioni che dipendono dalle condizione meteorologiche. Sebbene l'ozono stratosferico sia rimosso dalla reazione con radicali cloro e fluoro a tutte le latitudini, il buco dell'ozono si forma solo ai poli, ed in particolare sopra l'Antartide e solo in primavera. Perché? |
In che modo i radicali di alogeni distruggono l'ozono
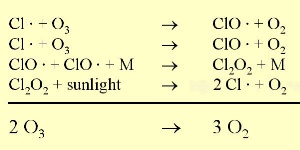
In condizioni naturali, i livelli di ozono sono relativamente costanti in quanto l’ozono è formato e distrutto dalla luce ultravioletta. Perciò quando le concentrazioni di ozono aumentano, aumenta anche la quantità di ozono che viene distrutto. Invece i radicali cloro (CI) reagiscono con l'ozono solo per distruggerlo e sono molto efficienti in questa loro azione perché agiscono come catalizzatori. Questo significa che non sono consumati dalla reazione ma sono riciclati e possono continuare a reagire con altre molecole di ozono per distruggerle allo stesso modo.
|
 |
 |
 |
|
3. La reazione ozono cloro. I puntini stanno ad indicare, che i partner della reazione sono radicali. Grandezza intera: 35 K
|
|
Le condizioni
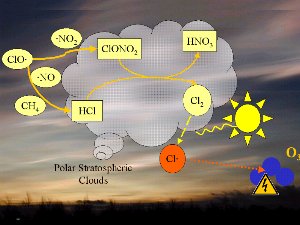
La decomposizione dei CFC crea radicali di monossido di cloro (CIO). Questi possono reagire con il biossido di azoto (NO2) per formare nitrato di cloro (CIONO2) o con il monossido di azoto (NO) e con il metano (CH4) per formare l'acido cloridrico (HCI) e acido nitrico (HNO3). In questa sede non ci focalizzeremo sulla chimica, ma è importante sapere che sia HCI che CIONO2 non reagiscono con l'ozono ma sono composti piuttosto stabili e rimuovono il cloro dai cicli di distruzione dell'ozono.
Il buco dell'ozono si forma solo in condizioni meteorologiche particolari. Dopo la scoperta del buco dell'ozono nel 1985 presso la Stazione di Ricerca Britannica a Halley Bay in Antartide, sono stati necessari circa tre anni di ricerche per capire finalmente quali fossero queste condizioni.
|
 |
 |
|
4. La chimica sulle nuvole stratosferiche polari crea pericolosi radicali cloro Cl (rosso).
Cliccare per allargare (100 K)!
|
|
 |
1. Un fattore importante è dato dalle temperature estremamente basse nella stratosfera. Durante la lunga notte polare le temperature sopra l'Antartide possono scendere fino a -80 °C. In queste condizioni, l'acido nitrico e l'acqua formano le nuvole di ghiaccio stratosferico. Sulla superficie del ghiaccio, l'acido cloridrico e CIONO2 reagiscono tra di loro per dare l'acido nitrico e cloro molecolare (CI2)
2. Il cloro molecolare (CI2) è una molecola stabile che non reagisce con l'ozono. Tuttavia, è facilmente distrutta dalla radiazione ultravioletta proveniente dal sole per formare due radicali cloro che possono in seguito attaccare e distruggere l'ozono (freccia arancione nell'immagine).
|
Durante l'inverno, nella stratosfera polare possono essere prodotti livelli elevati di cloro molecolare (Cl2). Solo in primavera, il sole riappare e la radiazione solare ultravioletta aumenta. Questa radiazione ultravioletta scinde il Cl2 in radicali cloro, che distruggono poi l'ozono con conseguente formazione del buco nell'ozono. Per questo motivo vediamo il buco dell'ozono ogni anno nello stesso periodo. L'ozono poi non torna ai livelli normali fino a quando le nuvole di ghiaccio non si sciolgono e i radicali cloro sono rimossi in seguito ad altre reazioni.
|
 |
 |
 |
|
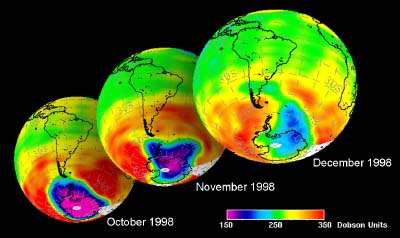
5. Sviluppo del buco dell'ozono nell'Antartico nella primavera del 1998. Dati GOME.
|
|
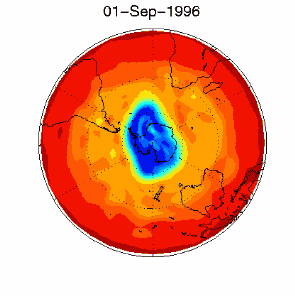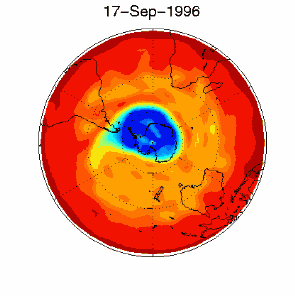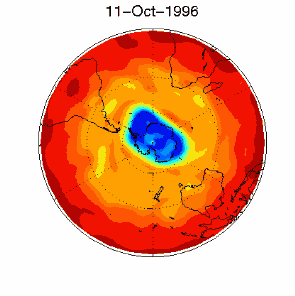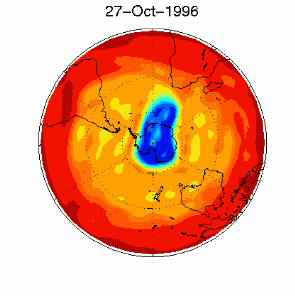 |
 |
|
6. Il buco dell'ozono nel vortice polare sopra l'Antartico nel Settembre / Ottobre 1996. Adattato da UKMO data set, pubblicato alla Brown University. Cliccare per una versione a più alta risoluzione (330 K)!
|
|
 |
3. Sono perciò necessarie condizioni meteorologiche particolari affinché il buco dell'ozono si possa sviluppare completamente. La formazione del radicale monossido di cloro (ClO) di solito si verifica nell’alta stratosfera, lontano dalla maggior parte delle molecole di ozono che si trovano ad altitudini comprese tra 14 e 22 km di altezza. Perciò, in teoria, i radicali cloro non dovrebbero influenzare troppo l'ozono stratosferico. Questo purtroppo non succede. Le condizioni meteorologiche particolari che si sviluppano intorno ai poli permettono la formazione di un vortice polare che causa un movimento di aria verso il basso. Questo trasporta ClO alle quote più basse dove può svolgere il suo ruolo di distruttore dell'ozono. |
|
Come puoi vedere, le condizioni necessarie per la formazione del buco dell'ozono:
- le temperature fredde durante gli inverni polari
- la formazione di nuvole di ghiaccio
- le speciali condizioni meteorologiche che originano il vortice polare
- seguite dal sorgere del sole polare in primavera
sono così particolari che era molto improbabile che gli scienziati potessero mai prevedere il buco dell'ozono.
|
Il futuro del buco dell'ozono
I CFC sono vietati in tutto il globo dal “Protocollo di Montreal sulle sostanze che impoveriscono lo strato di ozono – 1987” (e emendamenti successivi). Poiché le loro emivite atmosferiche sono così lunghe (fino a 100 anni) saranno necessari altri 50 anni prima che tutti i CFC rilasciati fino ad ora siano distrutti nella stratosfera e che le concentrazioni di ozono si stabilizzino. Era previsto che le concentrazioni massime di CFC nella stratosfera si verificassero nel 2000 ed infatti le dimensioni del buco dell'ozono sono rimaste piuttosto costanti negli ultimi anni. Tuttavia, ci sono eccezioni a questo andamento. Nel 2002 il buco dell'ozono non è stato rilevante. Il motivo è semplice: era troppo caldo e il vortice polare non si è formato come al solito. Di nuovo, un esempio di come i processi atmosferici ignorino a volte qualsiasi previsione! Ma nel 2003 il buco è tornato alla sua dimensione precedente, la seconda più grande mai osservata.
|
 |
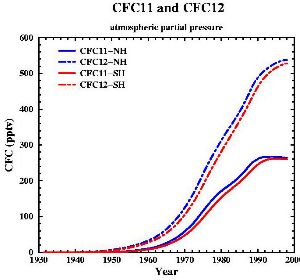 |
 |
|
7. Sviluppo delle concentrazioni dei due più importanti CFC (anche chiamati FREON 11 e FREON 12). Dati da: Walker et al., J. Geophys. Res., 105, 14,285-14,296, 2000 [internet plots]. Immagine di Gian-Kasper Plattner (Univ. of Bern, UCLA).
Cliccare per allargare!
|
|
Lavoro degli studenti sul buco dell'ozono e sui pericoli della luce UV per gli uomini e la natura:
in cooperazione con "Proklima" - Ozone Projekt of the GTZ
Ulteriori letture:
A proposito di questa pagina:
autore: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz, Germany.
1. revisione scientifica: Rajendra Shende, Head Energy and OzonAction, United Nations Environment Programme 2003-10-06
2. revisione scientifica: Dr. John Cowley - Max Planck Institute for Chemistry, Mainz - 2004-05-06
revisione didattica: Hendrik Forster and students - Nordpfalz Gymnasium, Kirchheim Bolanden, Germany - March 2004
ultima pubblicazione: 2009-03-23
|
|
 |
|







