|
|
 |
|
|
|
 |
| |
|
|
 |
A alta atmosfera
Saber mais |
A química do ozono estratosférico
A descoberta do buraco do ozono em 1985 conduziu a um aumento na investigação da química do ozono estratosférico. As secções seguintes apresentam brevemente a química da estratosfera e o seu enquadramento histórico.
|
|
|
|
|
 |
A descoberta do ozono e as primeiras medições
A investigação do ozono é um ramo da ciência da atmosfera relativamente antigo. Em 1840 o gás foi baptizado de “ozono” (o cheiro) pelo químico Christian Friedrich Schönbein, que descobriu que esta substância se formava durante descargas eléctricas. Pouco tempo depois descobriu-se que o ozono é um componente natural do ar. O primeiro método para medir o gás foi desenvolvido pelo próprio Schönbein, e o método foi posteriormente melhorado em Paris, no Observatório de Mont Souris. São deste observatório as primeiras séries temporais de dados de ozono (1876 - 1910) e estes dados dão-nos uma ideia de quais eram as concentrações atmosféricas na camada limite antes da revolução industrial.
|
 |
 |
 |
|
1. Christian Friedrich Schönbein
Fonte: Webpage Swiss Academy of Science techniques
|
|
 |
 |
|
2. O espectrómetro Dobson
Cortesia de: Ulf Köhler, DWD Hohenpeissenberg
Prima para aumentar! (130 K)
|
|
 |
Em 1879 a investigação mostrou que pouca radiação solar UV-B atingia a superfície da Terra. Um ano mais tarde descobriu-se que o ozono absorve fortemente a radiação naqueles comprimentos de onda e que, portanto, poderia ser responsável pela remoção da radiação UV-B. A quantidade de ozono disponível na baixa troposfera era, contudo, demasiado diminuta para justificar o declínio da radiação UV-B e admitiu-se (correctamente) que a maior parte do ozono se encontraria em camadas elevadas da atmosfera. A investigação chave deste assunto foi realizada por Gordon Dobson nos anos 1920. Dobson desenvolveu o espectrómetro Dobson que tem sido utilizado desde 1929 na medição da coluna de ozono total e que está ainda em uso, apesar de estar a ser gradualmente substituído por instrumentos mais modernos.
Para mais pormenores acerca do funcionamento do espectrómetro Dobson, prima  AQUI! AQUI!
|
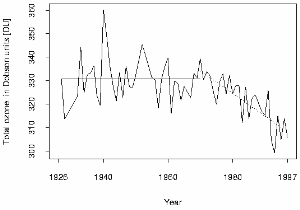
Um dos primeiros seis espectrómetros Dobson foi utilizado em Arosa, na Suiça, por Paul Götz, e é lá que existe a mais longa série temporal mundial de medições da coluna de ozono total. A tendência mostra que também na Europa a camada do ozono se tem tornado cada vez menos espessa. Em Hohenpeissenberg, na Alemanha, têm sido medidos recentemente valores inferiores a 300 DU, no verão, que corresponde a um limite crítico que torna necessária uma maior protecção contra a radiação solar nociva. Valores perigosos de 200 DU, têm também sido medidos na primavera, no período em que ocorre o buraco do ozono no Hemisfério Norte, em Março.
Nos anos de 1930, Götz mostrou que o máximo na concentração de ozono se encontraria provavelmente abaixo de uma altitude de 25 km. Como resultado do seu trabalho estabeleceu-se a localização da camada do ozono e mediu-se a sua espessura.
|
 |
 |
 |
|
3. A série temporal de ozono de Arosa
Fonte: ETH Zürich
|
|
 |
 |
|
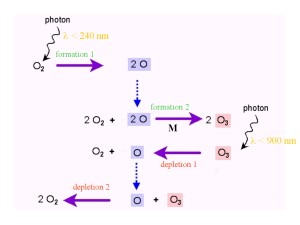
4. As reacções Chapman
Esquema por EU
Prima para aumentar! (40 K)
|
|
 |
As reacções Chapman
Como é então o ozono produzido e removido da atmosfera ? Em 1929 e 1930 Chapman publicou a teoria da formação e da depleção do ozono. As reacções propostas foram posteriormente confirmadas e são denominadas de “Ciclo de Chapman” ou “Reacções de Chapman”.
Estas reacções mostram como o oxigénio e o ozono se transformam um no outro. As ligações entre os átomos de oxigénio quebram-se por fotólise, devido à intensa radiação solar ultravioleta. É necessária mais energia para quebrar as ligações O-O na molécula O2 (comprimentos de onda inferiores a 240 nm) do que a energia necessária para quebrar as ligações O-O na molécula O3 (comprimentos de onda inferiores a 900 nm). As reacções de formação e de depleção do ozono estão em equilíbrio e o resultado final é uma reacção “nula”:
3 O2 -> 2 O3 e 2 O3 -> 3 O2
|
Absorção da radiação ultravioleta
Cada molécula absorve energia numa determinada gama do espectro electromagnético. Como as ligações entre os átomos nas moléculas têm intensidades variáveis, são necessárias diferentes quantidades de energia para as destruir. A ligação entre os dois átomos de oxigénio numa molécula de oxigénio (O2) é muito forte e só pode ser quebrada se a molécula absorver radiação UV-C, muito energética. As ligações entre os átomos de oxigénio no ozono são um pouco mais fracas e podem ser quebradas pela absorção da radiação UV-B, ligeiramente menos energética. A absorção desta radiação de curto comprimento de onda, muito energética, pelo O2 e pelo O3 na estratosfera evita que a radiação atinja a troposfera e aí os destrua (O2 e O3). A radiação menos energética (com comprimentos de onda maiores) atravessa a atmosfera, chegando à superfície da Terra.
|
 |
 |
 |
|
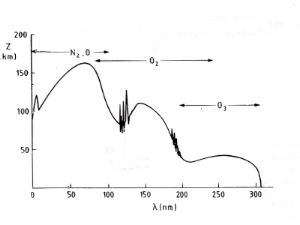
5. Espectro de absorção (à direita):
A imagem mostra os espectros combinados de absorção da radiação solar na alta atmosfera, pelos principais compostos atmosféricos. Indica as altitudes que atingem as diversas regiões do espectro de radiação solar. A radiação com comprimentos de onda inferiores a 200 nm é removida na ionosfera e na mesosfera através da absorção pelo nitrogénio (N2), por átomos de oxigénio (O) e pela molécula de oxigénio (O2). A radiação com comprimentos de onda entre 200 e 320 nm penetra até mais abaixo na estratosfera (abaixo dos 50 km), onde é absorvida essencialmente pelo ozono (O3). Finalmente, a radiação com comprimentos de onda superiores a 320 nm atinge a superfície da Terra.
|
|
|
Contudo, uma pequena fracção da radiação UV-B chega à superfície da Terra, permitindo a formação dos radicais OH que limpam a troposfera. Esta fracção é também crítica e tem implicações biológicas, como o bronzeado ou as alterações no ADN.
|
Depleção do ozono por radicais
As concentrações de ozono medidas não podem ser simplesmente explicadas pelas reacções de Chapman. A investigação científica conduzida desde 1970 tem mostrado que os óxidos de nitrogénio e os radicais reactivos de halogéneo também estão envolvidos na química do ozono. Os cientistas Paul Crutzen, Mario Molina e Sherwood F. Rowland receberam, em 1995, o Prémio Nobel da Química pelo seu trabalho nesta área. Molina e Rowland descobriram em 1974 que os clorofluorcarbonetos (CFC) destroem o ozono.
|
 |
 |
 |
|
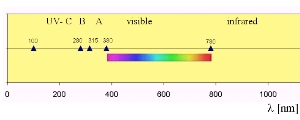
6. Radiação UV no espectro electromagnético
Para além da definição dada aqui, existem diversas definições para as gamas da radiação ultravioleta. Esta mostra radiação UV-A variando entre 315 e 380 nm; o IPCC define a radiação UV-A como tendo comprimentos de onda entre 315 e 400 nm.
Composto por: Elmar Uherek
Prima para aumentar! (60 K)
|
|
 |
 |
|
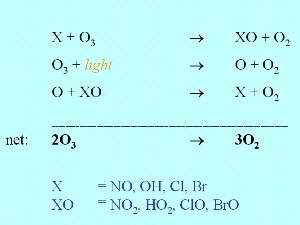
7. Depleção química do ozono
Prima para aumentar! (40 K)
|
|
 |
O ozono não é só removido por fotólise, pela radiação solar ultravioleta. Também o é pela reacção com compostos químicos reactivos, X , como o monóxido de azoto (NO), o radical hidroxilo ( , como o monóxido de azoto (NO), o radical hidroxilo ( OH) ou os radicais de halogéneo, tais como o cloro (Cl OH) ou os radicais de halogéneo, tais como o cloro (Cl ) e o bromo (Br ) e o bromo (Br ). Existem ainda outros radicais de menor importância que podem reagir de forma análoga. ). Existem ainda outros radicais de menor importância que podem reagir de forma análoga.
Um ligeiro decréscimo nas concentrações de ozono foi previsto pelos cientistas quando começaram a ser libertados para a atmosfera, pela actividade humana, quantidades significativas de elementos contendo halogéneo. Contudo ninguém previu que os níveis de ozono na estratosfera diminuíssem tão dramaticamente sobre a Antártida, antes da sua medição em 1985. |
Acerca desta página:
Autor: Dr. Elmar Uherek - MPI for Chemistry, Mainz
Revisão científica: Dr. Christoph Brühl - MPI for Chemistry, Mainz
Revisão educacional: Michael Seesing - Uni Duisburg - 2003-08-07
Versão portuguesa: Margarida L. R. Liberato - Dep. de Física, UTAD, Portugal
Última actualização: 2004-05-11
|
|
 |
|







