|
|
 |
|
|
|
 |
| |
|
|
 |
A alta atmosfera
Saber mais |
Química do cloro
A química do cloro é a principal responsável pela destruição da camada do ozono. A produção industrial e a utilização dos clorofluorcarbonetos (CFC) introduziram uma nova fonte de cloro na atmosfera. Actualmente existe seis vezes mais cloro do que o produzido por fontes naturais, com consequências dramáticas na camada do ozono. Contudo ninguém previu até que ponto estes compostos eram perigosos, porque as condições necessárias para a formação do buraco do ozono são tão pouco usuais.
|
|
|
|
|
 |
 |
 |
|
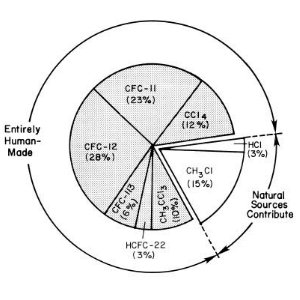
1. Principais fontes de cloro que entraram na estratosfera, no início dos anos 1990.
Fonte: UNEP/WMO Scientific Assessment of Ozone Depletion
|
|
 |
CFC – gases sem qualquer fonte natural
Os gases que provocam a depleção do ozono com o maior potencial para influenciar o clima são CFC-11 (CFCl3), CFC-12 (CF2Cl2), e CFC-113 (CF2ClCFCl2). Hoje em dia é claro, a partir de medições no ar polar, que não existe qualquer fonte natural destes compostos. A única fonte natural significativa de cloro é o cloreto de metilo (CH3Cl) e este composto tem um tempo de vida relativamente curto de apenas 1,3 anos. Compare-se com os longos tempos de vida dos CFC na troposfera, entre 50 e 100 anos.
Como os CFC não são quebrados nem pelo radical hidroxilo (OH) nem pela radiação solar na troposfera, os CFC conseguem ascender até à estratosfera onde, sob a influência da radiação solar ultravioleta muito energética, são degradados em átomos de cloro. A produção destes radicais não conduz, necessariamente, à depleção do ozono, havendo apenas uma perda de ozono significativa sob condições especiais, que veremos nas secções seguintes. |
As condições peculiares do buraco do ozono antárctico
Durante a noite polar as temperaturas do ar podem descer até -80ºC. Sob estas condições, as pequenas quantidades de água e de ácido nítrico presentes na estratosfera gelam, formando as nuvens estratosféricas polares. Podem então ocorrer as cinco condições chave:
|
|
|
 |
Segunda: O HCl e o ClONO2 reagem um com o outro à superfície das nuvens estratosféricas polares produzindo Cl2 e HNO3. Este ácido nítrico é imediatamente incorporado nas partículas de gelo das nuvens.
Terceira: Quando o Sol nasce, no final do Inverno polar, o Cl2 é degradado pela radiação solar, produzindo-se dois radicais Cl . O cloro é de novo reactivo. . O cloro é de novo reactivo.
|
|
|
 |
Quinta: Normalmente formam-se espécies de cloro tais como Cl , ClO , ClO , e Cl2O2 , que se concentram na alta estratosfera, enquanto que o ozono se encontra principalmente na baixa estratosfera. Portanto os cientistas pensaram que o ozono e os agentes químicos destruidores do ozono só estariam juntos em regiões fronteira. Consequentemente não seria de esperar que os níveis de ozono decrescessem significativamente, apesar das concentrações de compostos contendo cloro aumentarem na estratosfera. Mas não se tomou em consideração a existência do vórtice polar. Este vórtice (vento circumpolar), estável do ponto de vista meteorológico, com o pólo localizado aproximadamente no seu centro, transporta o ar rico em cloro desde a alta e média estratosfera até à baixa estratosfera, rica em ozono. Favorece assim a destruição significativa do ozono. , e Cl2O2 , que se concentram na alta estratosfera, enquanto que o ozono se encontra principalmente na baixa estratosfera. Portanto os cientistas pensaram que o ozono e os agentes químicos destruidores do ozono só estariam juntos em regiões fronteira. Consequentemente não seria de esperar que os níveis de ozono decrescessem significativamente, apesar das concentrações de compostos contendo cloro aumentarem na estratosfera. Mas não se tomou em consideração a existência do vórtice polar. Este vórtice (vento circumpolar), estável do ponto de vista meteorológico, com o pólo localizado aproximadamente no seu centro, transporta o ar rico em cloro desde a alta e média estratosfera até à baixa estratosfera, rica em ozono. Favorece assim a destruição significativa do ozono.
Eis como as espécies cloro destruidoras do ozono são transportadas para altitudes inferiores, para a região onde está acumulada a maior parte do ozono. |
Juntam-se as cinco condições que permitem a formação do buraco do ozono. Por este motivo a maior depleção do ozono ocorre apenas na região polar (principalmente na região antárctica) e apenas na Primavera, assim que o Sol nasce após o Inverno polar (Setembro/Outubro).
Mais tarde, ao longo do ano, as temperaturas do ar sobem, as nuvens polares derretem, os óxidos de nitrogénio tornam-se disponíveis novamente, o vórtice polar desaparece, impedindo o transporte para a baixa estratosfera de espécies reactivas de cloro, e a camada do ozono recupera.
Por vezes ocorrem condições comparáveis sobre o ártico, em Março, formando-se também um pequeno buraco do ozono sobre o norte da Europa.
|
 |
 |
 |
|
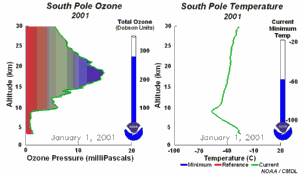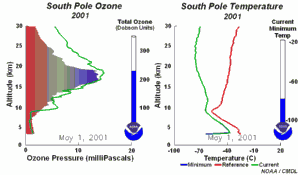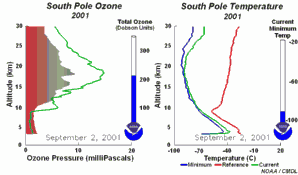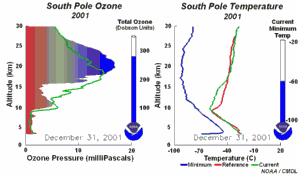
4. O desenvolvimento do buraco do ozono de 2001
Prima para aumentar a sequência de 5 dias (270 K)!
Animação original disponibilizada pelo NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado.
|
|
M*: Em qualquer reacção do tipo A + B -> C é necessário um outro elemento, que absorva a energia em excesso. De outro modo o produto C teria a mesma energia que a energia armazenada na soma dos reagentes A + B e ocorreria a reacção na direcção oposta. Na maioria destes casos M é o nitrogénio (N2), do ar.
|
Acerca desta página:
Autor: Dr. Elmar Uherek - MPI for Chemistry, Mainz
Revisão científica: Dr. Christoph Brühl - MPI for Chemistry, Mainz
Revisão educacional: Michael Seesing - Uni Duisburg - 2003-08-07
Versão portuguesa: Margarida L. R. Liberato - Dep. de Física, UTAD, Portugal
Última actualização: 2004-05-11 |
|
 |
|







