|
|
 |
|
|
|
 |
| |
|
|
 |
Obere Atmosphäre
Basis |
Fluorchlorkohlenwasserstoffe FCKW und das Ozonloch
Die Geschichte des Ozonlochs ist ein gutes Beispiel dafür, wie eine anscheinend harmlose Klasse von Chemikalien zu einer wirklichen Gefahr für das Leben auf der Erde werden konnte und wie Regierungen, Industrie und die Gesellschaft zusammenarbeiteten, um dieses Problem bewusst zu machen und zu lösen. |
|
|
|
|
 |
|
Wir können hieraus lernen, dass alle Veränderungen, die der Mensch im Klimasystem vornimmt, ein natürliches Gleichgewicht in unvorhergesehener Weise stören können. Zum anderen kann aber auch eine zielstrebige Zusammenarbeit der Weltgemeinschaft erreichen, dass Umweltprobleme effektiv angegangen werden.
FCKW sind nur eine Klasse von Chemikalien unter anderen, die die Ozonschicht abbauen, aber sie sind die wichtigste.
|
Nutzung und Eigenschaften von FCKW
Fluorchlorkohlenwasserstoffe (FCKW) sind voll halogenierte Kohlenstoffverbindungen wie CFCl3 oder CF2Cl2. Kommerziell, obwohl eigentlich ein Markenname, hat sich die Bezeichnung FREON eingebürgert. FCKW wurden in einer Fülle von Fabrikationsschritten, als Kühlmittel, als Lösemittel in der Elektronindustrie, als Schaumbildner, Treibgase, Feuerlöschmittel, Trockenreinigungsgase sowie in der Herstellung und Nutzung von Isolierschäumen für Gebäude und Haushalt und von Verpackungsschaumstoffen genutzt.
Der Grund für ihre Verbreitung und Beliebtheit war, dass sie als Gase völlig unreaktiv sind und die menschliche Gesundheit in keiner Weise belasten. Sie reagieren weder in der troposphärischen Luft noch in unserem Körper. Daher rührte auch ihre sehr lange Lebenszeit, die zu einer Anreicherung in der Atmosphäre führte. Was tragischerweise nicht von uns berücksichtigt wurde: FCKW werden von energiereicher UV Strahlung der Sonne gespalten.
|
 |
 |
 |
|
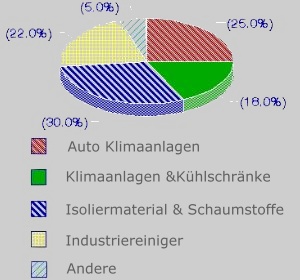
1. Nutzung von FCKW
Information der US Umweltbehörde (EPA)
|
|
|
Aktuelle Entwicklung auf dem Markt
Die Produktion von FCKW ist weitgehend verboten. Sie wurden durch teilhalognierte Kohlenwasserstoffe (H-FKW, H-FCKW*) oder andere Substanzen ersetzt. Aber auch H-FCKW tragen (in geringerem Maße) zur Ozonzerstörung bei. Sowohl H-FCKW als auch H-FKW sind Treibhausgase. Zudem sind noch viele FCKW im Umlauf bzw. in bislang nicht entsorgten Geräten gespeichert. Hierdurch ergibt sich ein komplexes Bild für die Menge, die noch in die Atmosphäre gelangt.
* H-FCKW = teilhalogenierte Fluorchlorkohlenwasserstoffe, H-FKW = teilhalogenierte Fluorkohlenwasserstoffe |
 |
 |
|
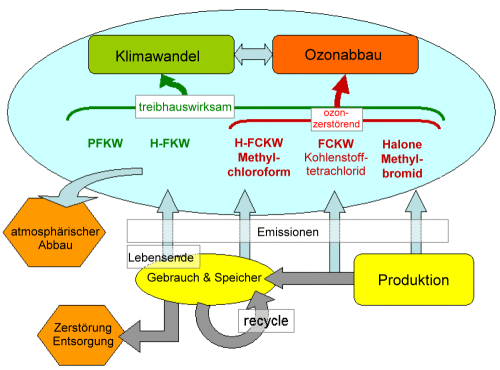
2. Flussdiagramm von halogenierten Verbindungen mit Auswirkung auf den Treibhauseffekt und partiell das Ozonloch. Quelle: IPCC/TEAP fig. SPM-1
|
Während die Gefahr für die Ozonschicht allmählich sinken wird, dadurch dass die FCKW-Vorräte über die nächsten Jahre abgebaut werden, bleibt die Problematik der Treibhauswirkung erhalten. Die Ersatzstoffe haben immer noch ein großes Erderwärmungspotential und die Nachfrage nach Klimaanlagen in Autos und in Häusern sowie nach Kühlgeräten wird tendenziell eher steigen.
|
 |
 |
 |
|
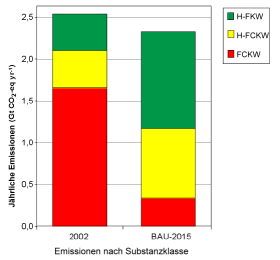
3. Die Emissionen halogenierter Verbindungen werden sich von FCKW auf ihre Ersatzstoffe verlagern, wenn die Entwicklung dem bisherigen Trend folgt ("business-as-usual" BAU Szenario). Quelle: IPCC/TEAP fig. SPM-4
|
|
 |
 |
|
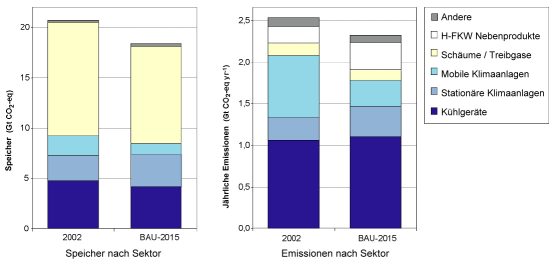
4. Speicher und jährliche Emissionen aller halogenierten Verbindungen nach Sektoren zusammengefasst. Hauptanwendungen sind Klimaanlagen und Kühlgeräte. Die Größen sind in CO2-Äquivalenten ausgedrückt, d.h. auf die Menge CO2 umgerechnet, die die gleiche Treibhauswirkung hat. Zum Vergleich: Die jährlichen CO2 Emissionen aus menschlicher Aktivität liegen bei ca. 7 GtC.
Quelle: IPCC/TEAP fig. SPM-4
|
 |
 |
|
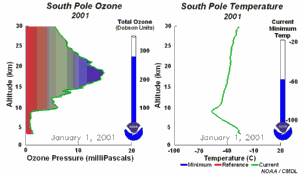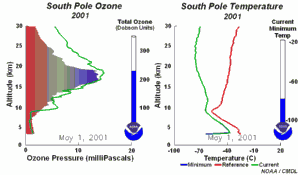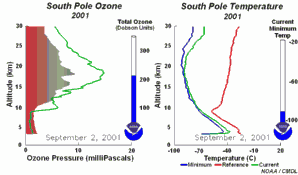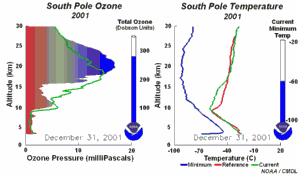
5. Die Entwicklung des Ozonlochs im Jahr 2001
Die Animation zeigt links die Entwicklung der Ozonkonzentrationen über der Antarktis in allen Höhen während des ganzen Jahres, rechts dazu die herrschende Temperatur (aktueller Wert = grün). Bitte beachten, dass am Südpol im Juli / August Winter und Polarnacht herrschen.
Bei Anklicken dieser Grafik wird eine größere Version mit einer Abfolge von 5 Tagen angeboten (270 K)!
Die Originalanimation wurde erstellt vom NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado
|
|
 |
Das stratosphärische Schicksal der FCKW
Da das starke UV-B Licht von der Sonne durch die Ozonschicht in der Stratosphäre abgefangen wird, ist die Strahlung, die die Troposphäre erreicht, zu schwach, um die FCKW in nennenswertem Maße abzubauen. So drangen sie nach und nach in die Stratosphäre ein, wo nun allerdings diese Abbauprozesse abliefen. Denn hier gibt es ja starkes UV Licht.
Der Abbau führt zur Freisetzung von Chlor- und Fluorradikalen. Hieraus alleine muss kein starker Rückgang des Ozons hervorgehen. Zwar sind die Chlorradikale die Hauptverantwortlichen für den Ozonabbau, aber je nach äußeren Bedingungen gehen sie auch andere Reaktionen ein. Stratosphärisches Ozon wird in allen Breiten reduziert, auch über unseren Köpfen. Ein Ozonloch in seiner extremen Form aber bildete sich nur über den Polargebieten, insbesondere über der Antarktis und dies auch nur im Frühling. Was ist der Grund?
|
Die chemischen Reaktionen
Ozon befindet sich in der Ozonschicht in einem Zustand des Gleichgewichtes. Durch UV Licht wird es ab- und wieder aufgebaut. Chlorradikale (Cl ) sind Katalysatoren, die in einer Kettenreaktion ausschließlich zum Abbau des Ozons führen, aber nicht zu neuem Aufbau. Sie sind deshalb im Ozonabbau so erfolgreich, weil sie während der chemischen Reaktion selbst nicht verbraucht sondern immer wieder recycelt werden. ) sind Katalysatoren, die in einer Kettenreaktion ausschließlich zum Abbau des Ozons führen, aber nicht zu neuem Aufbau. Sie sind deshalb im Ozonabbau so erfolgreich, weil sie während der chemischen Reaktion selbst nicht verbraucht sondern immer wieder recycelt werden.
|
 |
 |
 |
|
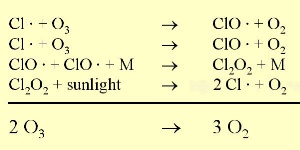
6. Chlor Ozon Reaktion. Die Punkte zeigen an, dass die Reaktionspartner Radikale sind.
Vollgröße: 35 K
|
|
Die Bedingungen
Der Abbau der FCKW führt nach weiteren Reaktionen zu ClO Radikalen. Diese können mit Stickstoffdixoid (NO2) zu ClONO2 reagieren oder mit Stickstoffmonoxid (NO) und Methan zu Salzsäure (HCl) und Salpetersäure (HNO3). Wir schauen uns hier die Chemie nicht näher an. Wichtig zu wissen ist aber: HCl und ClONO2 sind relativ stabil und reagieren nicht mit Ozon. Nur bestimmte Bedingungen aktivieren die aggressiven Chlorradikale für den Ozonabbau. Drei Jahre intensiver Forschung bedurfte es nach der Entdeckung des Ozonlochs im Jahr 1985 an der Britischen Forschungsstation Halley Bey in der Antarktis, bevor diese komplexen Bedingungen gut verstanden waren. Radikalen. Diese können mit Stickstoffdixoid (NO2) zu ClONO2 reagieren oder mit Stickstoffmonoxid (NO) und Methan zu Salzsäure (HCl) und Salpetersäure (HNO3). Wir schauen uns hier die Chemie nicht näher an. Wichtig zu wissen ist aber: HCl und ClONO2 sind relativ stabil und reagieren nicht mit Ozon. Nur bestimmte Bedingungen aktivieren die aggressiven Chlorradikale für den Ozonabbau. Drei Jahre intensiver Forschung bedurfte es nach der Entdeckung des Ozonlochs im Jahr 1985 an der Britischen Forschungsstation Halley Bey in der Antarktis, bevor diese komplexen Bedingungen gut verstanden waren.
|
 |
 |
|
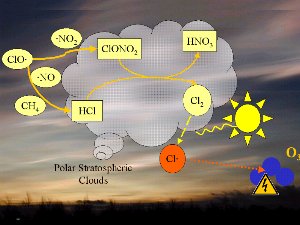
7. Die Chemie an polaren Stratosphärenwolken (PSC) führt zur Bildung aggressiver Chlorradikale (rot).
Bitte die Grafik zum Vergrößern anklicken (100 K)!
|
|
 |
1) Eine Bedingung sind die extrem niedrigen Temperaturen von etwa -80°C oder darunter, die während der Polarnacht über der Antarktis herrschen. Unter solchen Bedingungen bilden Salpetersäure und Wasser stratosphärische Eiswolken, die bei höheren Temperaturen nicht mehr stabil blieben. An der Oberfläche solcher Wolken können sich HCl und ClONO2 chemisch zu Salpetersäure und reinem Chlor Cl2 umsetzen.
2) Zwar ist Chlorgas Cl2 ein stabiles Molekül und reagiert nicht mit Ozon, aber vom Sonnenlicht wird es leicht in zwei Radikale Cl gespalten, welche nun wiederum (oranger Pfeil im Bild) das Ozon angreifen. gespalten, welche nun wiederum (oranger Pfeil im Bild) das Ozon angreifen.
|
Wie oben gesehen ist es das Chlorradikal, das vor allem zum Ozonabbau beiträgt. Es bildet sich aber erst dann, wenn das notwendige Sonnenlicht für die Chlorspaltung verfügbar ist, d.h. im antarktischen Frühling. Deshalb beobachten wir seine Bildung jedes Jahr im September und Oktober. Der Abbau läuft auch nur so lange ab, bis andere Reaktionspartner in den Eiswolken aufgetaut sind und die Chlorradikale anderweitig reagieren können.
|
 |
 |
 |
|
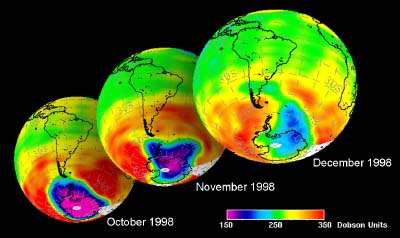
8. Entwicklung des Ozonloches im antarktischen Frühling 1998
Daten von GOME
|
|
|
|
 |
3) Schließlich hatte man das Ausmaß eines möglichen Ozonabbaus in der Höhe zwischen 14 und 22 km unterschätzt, weil die Bildung von ClO gewöhnlich in höheren Schichten erfolgt, in denen aber gar nicht mehr so viel Ozon gebildet wird. Um wirklich den Kern der Ozonschicht anzugreifen, ist ein Transport in tiefere Regionen notwendig. Dieser erfolgt im Polarwirbel (polar vortex), einem stabilen Windsystem, das sich rund um die Antarktis aufbaut. gewöhnlich in höheren Schichten erfolgt, in denen aber gar nicht mehr so viel Ozon gebildet wird. Um wirklich den Kern der Ozonschicht anzugreifen, ist ein Transport in tiefere Regionen notwendig. Dieser erfolgt im Polarwirbel (polar vortex), einem stabilen Windsystem, das sich rund um die Antarktis aufbaut.
Wie wir sehen, sind die Bedingungen (tiefe Temperatur, Eiswolken, polarer Wirbel gefolgt vom polaren Sonnenaufgang) für einen derart starken Ozonabbau so speziell, dass dieser Prozess nie vorhergesagt worden wäre, bis Forscher ihn real beobachteten.
|
|
|
 |
MPEG-1 Film des Ozonlochs 2006. Bereitgestellt von NASA Ozone Hole Watch.
Hier finden sich weitere Film-Animationen: -> NASA Ozone Hole Watch Webseite
|
Die Zukunft des Ozonlochs
Der Einsatz von FCKW ist mittlerweile weltweit verboten, gemäß dem Montrealer Protokoll zu Substanzen, die die Ozonschicht abbauen von 1987 und weiteren Vereinbarungen. Auf Grund ihrer langen Lebensdauer wird es noch etwa 50 Jahre dauern, bis die bis dato freigesetzten FCKW aus der Stratosphäre entfernt sind und sich in der Ozonschicht hoffentlich wieder ein stabiles Gleichgewicht einstellt. Wir nehmen an, dass das Ozonloch um das Jahr 2000 seine maximale Ausdehnung erreicht hat. Das Ozonloch der letzten Jahre war in seiner Größe recht stabil. Ausnahmen kann es jedoch immer geben. So wurde in 2002 fast überhaupt kein Ozonloch beobachtet, weil es unverhältnismäßig warm war und sich kein stabiler Polarwirbel ausgebildet hat. Ein Beispiel dafür, dass atmosphärische Prozesse immer unvorhergesehen ablaufen können. Danach jedoch kehrte das Loch wieder zu alter Größe zurück.
|
 |
 |
 |
|
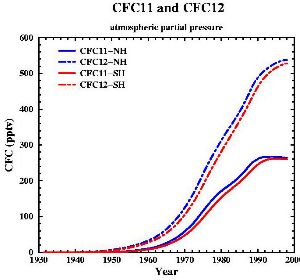
10. Die zeitliche Entwicklung der Konzentration der beiden häufigsten FCKW (FREON 11 und FREON 12).
Daten aus: Walker et al., J. Geophys. Res., 105, 14,285-14,296, 2000; Diagramm von: Gian-Kasper Plattner (Univ. of Bern, UCLA)
|
|
Schülerarbeit zu Ozonloch und UV-Gefährdungen von Mensch und Natur:
Ozzy Ozone Film in deutsch zum direkten Download HIER ANKLICKEN:
Real Media file (rm) - 8 MB oder MPEG-Film - 77 MB zum Abspeichern auf Festplatte.
in Zusammenarbeit mit  Proklima - Ozonprojekt der GTZ. Proklima - Ozonprojekt der GTZ.
Empfohlene weiterführende Literatur in englischer Sprache:
About this page:
author: Elmar Uherek - Max Planck Institute for Chemistry, Mainz
1. scientific reviewing: Dr. Rajendra Shende, Head Energy and Ozone Action, United Nations Environment Programme 2003-10-06
2. scientific reviewing: Dr. John Crowley - MPI Chemistry, Mainz 2004-05-06
educational reviewing: Hendrik Förster & students, Nordpfalz Gymnasium Kirchheim-Bolanden - March 2004
Letzte Überarbeitung: 2007-08-23 |
|
 |
|







