|
|
 |
|
|
|
 |
| |
|
|
 |
Basse atmosphère
Plus |
Le dioxyde de carbone et le méthane: deux gaz à effet de serre redoutables
La vapeur d'eau est le gaz à effet de serre le plus important. Mais le dioxyde de carbone (CO2) et le méthane (CH4) sont loin d'être négligeables. Les concentrations de ces deux gaz sont très éloignées de celle de la vapeur d'eau, mais ils ferment partiellement la fenêtre atmosphérique qui permet à la chaleur de s'échapper de l'atmosphère. Et leurs concentrations augmentent sans arrêt...
|
|
|
|
|
 |
|
|
 |
Cette image montre pourquoi ces gaz sont efficaces pour favoriser l'effet de serre. La vapeur d'eau absorbe une grande partie des longueurs d'ondes des rayons infrarouges émis par la surface terrestre et conserve ainsi la chaleur. Cependant pour certaines longueurs d'onde l'absorption est faible ou quasi nulle et la barrière qu'est la vapeur d'eau devient une fenêtre perméable. C'est exactement à ces longueurs d'onde que les autres gaz à effet de serre tels que le CO2 ou le CH4, mais aussi le protoxyde d'azote, l'ozone et les chlorofluorocarbones absorbent et diminuent donc la fenêtre.
|
|
Pour une même augmentation des concentrations qui pourrait avoir lieu, leurs effets sont plus forts que celui de la vapeur d'eau. Ces gaz à effet de serre sont plus efficaces. L'impact d'un gaz sur l'effet de serre dépend de sa concentration mais aussi de son efficacité.
Les scientifiques ont inventé un Potentiel de Réchauffement Global (GWP) pour comparer avec quelle efficacité chaque gaz à effet de serre capture la chaleur dans l'atmosphère, par rapport à un gaz de référence. Le dioxyde de carbone a été choisi comme référence et les efficacités des autres gaz lui sont comparées.
|
|
On peut voir dans ce tableau, pour les différents gaz à effet de serre, leur concentration avant la révoltution industrielle (1750), en 1998 et leur Potentiel de Réchauffement Global (GWP) dans 100 ans. Données de IPCC TAR 2001:
|
Gaz à effet de serre |
concentration en 1750 |
concentration en 1998 |
GWP dans 100 ans |
|
dioxyde de carbone CO2 |
280 ppm |
365 ppm |
1 |
|
méthane CH4 |
700 ppb |
1745 ppb |
23 |
|
protoxyde d'azote N2O |
270 ppb |
314 ppb |
296 |
|
ozone troposphérique* O3 |
25 DU
(10 ppb) |
34 DU
(30-40 ppb) |
|
|
CFC-11 CFCl3 |
0 |
268 ppt |
4600 |
|
CFC-12 CF2Cl2 |
0 |
533 ppt |
10600 |
1 DU = Unité Dobson = 0,01 mm d'épaisseur d'ozone pur
*l'ozone n'étant pas également réparti dans l'atmosphère, seuls les rapports de mélange moyens de la basse troposphère sont donnés
| |
L'augmentation des émissions de CO2
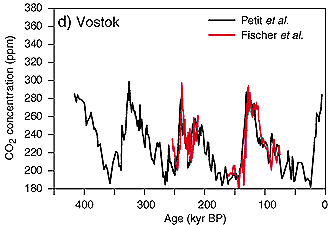
D'après les analyses dans les carottages de glaces polaires, on sait que les concentrations de CO2 dans l'air durant ces derniers 400 000 ans ont varié entre 180 ppm (0,018%) pendant les périodes glaciaires et 280 ppm pendant les périodes interglaciaires. Ces valeurs ont changé depuis le début de l'industrialisation et l'exploitation grandissante par les humains de combustibles fossiles (charbon, gaz naturel et pétrole). Les émissions de CO2 n'ont cessé d'augmenter et atteignent actuellement 370 ppm. Par comparaison avec la situation globalement stable pendant plusieurs milliers d'années, l'augmentation de CO2 durant ces dernières 200 années a été rapide et causée par les humains. Quelles sont les émissions qui contribuent à cette augmentation?
|
 |
 |
 |
|
2. les concentrations de CO2 durant ces 400 000 dernières années d'après les carottages de glace de Vostok
source: IPCC TAR 2001 fig 3-2
|
|
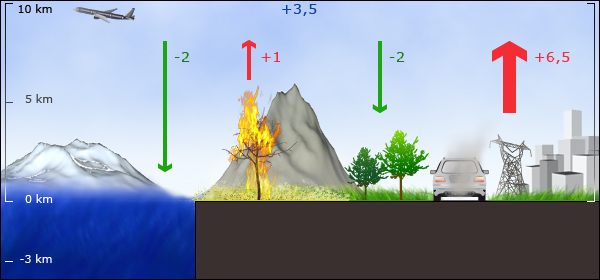
Chaque année les humains émettent plusieurs milliards de tonnes de carbone dans l'atmosphère (1 Pétagramme de Carbone = PgC = 1x1015 g = 1 milliard de tonnes de carbone) : 5,4 ± 0.3 PgC/an dans les années 80, et 6,3 ± 0,4 PgC/an dans les années 90, quasi exclusivement à cause de la combustion des énergies fossiles. Entre 1,5 et 2 PgC/an proviennent du changement de l'utilisation des sols (déforestation des forêts pour en faire des terres agricoles), principalement à cause des feux de végétation. On ne connaît pas très bien par contre les quantités qui disparaissent naturellment de l'atmosphère. Entre 3,2 et 3,3 ± 0.1 PgC/an restent dans l'atmosphère. Les océans en absorberaient entre 1 et 2 PgC / an.
|
 |
 |
 |
|
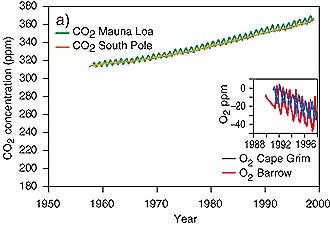
3. Evolution du CO2 ces dernières 50 années. L'augmentation du CO2 s'accompagne d'une légère perte en oxygène de l'atmosphère, car cet oxygène est utilisé pour les réactions chimiques qui sont augmentées.
source: IPCC TAR fig 3-2
|
|
|
On suppose que la végétation en absorbe beaucoup (environ 2 PgC/an). Néanmoins la fixation du CO2 par les plantes peut facilement varier d'un facteur 2 d'une année sur l'autre, en fonction des conditions météorologiques, qui sont soumises par exemple à El Niño.
|
 |
 |
|
4. Le bilan du CO2 : Valeurs moyennes d'émission et de disparition pour les années 80 en PgC par an. La combustion d'énergies fossiles et la déforestation sont des sources, tandis que les océans et la végétation sont des "puits".
image par Anja Kaiser © ESPERE, données de IPCC AR4 2007
|
|
Le cycle du carbone
Les échanges de CO2 entre la matière vivante et l'atmosphère se font en quantités bien plus importantes que celles indiquées ci-dessus. On suppose que chaque année environ 270 PgC se dissolvent dans l'eau ou sont temporairement conservés par la respiration des végétaux. Environ 60 PgC/an servent au développement des plantes, appelé production primaire nette PPN. Puisque le cycle naturel du carbone est en équilibre, tout ce PPN retourne à l'atmosphère: la quantité de carbone consommée par les plantes pour se développer est la même que celle qui est émise à cause des feux naturels ou de la respiration des êtres vivants autres que végétaux. Sans l'action extérieure de l'Homme, les concentrations de CO2 dans l'atmosphère changent peu. Cet équilibre naturel a été rompu par les activités humaines.
|
|
En moyenne sur la Terre, les concentrations de méthane étaient de 1745 ppb en 1998 (0,0001745 % de l'air). Les scientifiques sont assez sûrs de ce chiffre, et le méthane est bien réparti dans la troposphère. Cependant les émissions par les zones humides ont des variations importantes et il est possible que la production de méthane par les rizières ait été surestimée. Le tableau ci-dessous donne les valeurs de méthane estimées par deux groupes de scientifiques différents. |
|
Sources de méthane (émissions annuelles planétaires), en Tg/an (Tg = Téragrammes, soit des millions de tonnes/an) :
|
Source |
émissions [Tg CH4 / an]
(Hein et al., 1997) |
émissions [Tg CH4 / an]
(Lelieveld et al., 1998) |
|
zones humides et rizières |
325
(237 + 88) |
225 |
|
secteur de l'énergie |
97 |
110 |
|
ruminants |
90
(traitement des déchets inclus) |
115 |
|
enfouissement des déchets |
35 |
40 |
|
combustion de biomasse |
40 |
40 |
|
autres |
- |
(70) |
|
Total |
587 |
600 | |
|
 |
 |
|
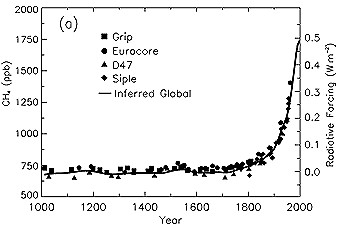
6. L'évolution des concentrations de CH4 (en fraction molaire, soit des ppb = 10-9) d'après les prélèvements dans des carottages de glace ou des échantillonnages d'air, pour les derniers 1000 ans. Le forçage radiatif par rapport à l'époque préindustrielle est indiqué sur l'axe de droite.
Source: IPCC TAR Fig. 4-1
|
|
 |
Environ 60% des émissions de méthane sont dues aux activités humaines, telles que l'agriculture, l'utilisation de combustibles fossiles et la destruction des déchets. De part la croissance continuelle de ces activités, les concentrations de méthane ont plus que doublé en 1000 ans.
La réaction qui permet au méthane de disparaître est la suivante, avec OH:
 OH + CH4 -> OH + CH4 ->  CH3 + H2O CH3 + H2O
Mais cette réaction est lente et la durée de vie du méthane dans l'atmosphère est d'environ 8 ans et demi.
|
Les hydrates de méthane
Il existe des quantités énormes de méthane CH4 (une réserve énergétique incroyable) qui est à l'heure actuelle stocké sous forme d'hydrates de méthane, et ainsi piégé dans la glace et qui est très stable à basse température et pression élevée (comme par exemple au fond des océans ou dans les couches profondes du permafrost). On pense qu'il y en a environ 10 000 PgC, soit à peu près deux fois plus que la quantité de combustibles fossiles (pétrole, gaz, charbon) sur Terre. Durant les derniers 400 000 ans, il semble d'après l'analyse des glaces en Antarctique que ces immenses ressources ne se sont pas échappé. Mais on ne sait pas dans quelle mesure l'augmentation des températures sur Terre ne pourrait pas conduire à une décomposition des hydrates de méthane dans les siècles à venir, ce qui augmenterait encore les conséquences désastreuses de l'effet de serre.
|
 |
 |
 |
|
7. Lorsque de l'hydrate de méthane fond, le méthane s'enflamme et il reste de l'eau liquide.
(c) GEOMAR 2002
|
|
A propos de cette page:
auteur: Dr. Elmar Uherek - MPI for Chemistry Mainz
relecteur scientifique: Dr. Benedikt Steil - MPI for chemistry, Mainz 2004-05-16
relecteur pédagogique: Michael Seesing - Uni Duisburg - 2003-07-02, Yvonne Schleicher - Uni Erlangen
dernière version: 2008-10-09 |
|
 |
|







