|
|
 |
|
|
|
 |
| |
|
|
 |
Untere Atmosphäre
Mehr .. |
Verteilung & Konzentration (1)
Wir haben eine Menge über Gase in der Atmosphäre gelernt, insbesondere in der Troposphäre, der untersten Schicht der Atmosphäre. Hier finden wir zahllose chemische Verbindungen in der Luft. Aber ihre Konzentration und Verteilung schwankt stark.
|
|
|
|
|
 |
Wie beschreiben wir die Rolle eines Gases in der Atmosphäre?
Menge
Ein Gas in der Atmosphäre kann sein ..
a) ein Hauptbestandteil der Luft (Sauerstoff, Stickstoff, Argon)
b) ein in größerer Menge auftretendes Spurengas (Kohlendioxid, Methan, Ozon, Stickstoffdioxid, ...)
c) ein in kleinerer Menge auftretendes Spurengas (viele organische Gase wie Butan, Ethanol, aber auch FCKW, ..)
Spurengase sind Gase, die nur einen sehr kleinen Anteil an der Luft ausmachen. Dies kann ein Molekül unter einer Milliarde oder sogar einer Billion an Luftmolekülen sein.
|
 |
|
Wie stellen wir uns ein ppb vor?
ppb = parts per billion (American *)
milliardstel Anteil
korrekter ausgedrückt: nmol/mol
1 Molekül unter 1.000.000.000
1 Inder in Indien, 1 Cent unter 10 Mio EURO, 1 Sekunde in 32 Jahren.
Und ein 1 ppt?
ppt = parts per trillion (American *)
billionstel Anteil
korrekter ausgedrückt: pmol/mol
1 Molekül unter
1.000.000.000.000
1 Briefmarke auf der Fläche von Paris ...
Es ist so wenig, dass wir es uns nicht vorstellen können, aber die moderne Wissenschaft kann es nachweisen.
| | |
*Das Missverständnis bei Mischungsverhältnissen in den 'Einheiten' ppm and ppb
In sehr vielen wissenschaftlichen und nicht wissenschaftlichen Veröffentlichungen wird die Menge eines Gases in der Luft in ppm (millionstel Teilen) oder ppb (milliardstel Teilen) angegeben. Wir benutzen diese Angaben auch hier, weil sie allgemein gebräuchlich sind. Allerdings werden sie oft falsch verstanden.
Drei typische Fehler:
1) Oft findet man geschrieben: Die Konzentration an CO2 in der Luft ist 385 ppm. Dies ist falsch. Denn 385 ppm ist ein Mischungsverhältnis und keine Konzentration. Konzentrationen sind zum Beispiel eine Masse pro Volumen, wie die Ozon-Konzentration 100 µg / m3. Sie haben eine richtige Einheit.
2) Mischungsverhältnisse haben keine richtige Einheit, da man die Einheiten wegkürzen kann, so dass nur eine Zahl stehen bleibt. Wir beschreiben nur, dass wir 385 Moleküle unter 1.000.000 Molekülen haben, wenn wir von 385 ppm sprechen. Die korrektere Ausdrucksweise ist: 385 µmol/mol.
3) Die Begriffe Billion und Trillion werden in verschiedenen Ländern verschieden definiert:
1 amerikanische Billion = 1 britische Milliarde (dort selten genutzt) = 1 deutsche Milliarde (hier immer genutzt) = 1.000.000.000
1 amerikanische Trillion = 1 deutsche Billion = 1.000.000.000.000
1 part per trillion ist also ein billionstel Anteil
In vielen Sprachen (französisch: milliard, deutsch: Milliarde) ist also die Bezeichnung der (in Großbritiannien selbst fast nie verwandten) britischen Milliarde (1 British milliard) verwandt und nicht der amerikanischen Billion = 109. In wissenschaftlichen Veröffentlichungen findet man aber fast ausschließlich letztere. Also nicht verwechseln!
|
oft benutzt: |
korrekter ausgedrückt: |
bedeutet: |
|
ppm (parts per million) |
µmol / mol = 10-6
(mikromol / mol) |
1 unter 1.000.000 |
|
ppb (parts per billion) amerikanisch |
nmol / mol = 10-9
(nanomol / mol) |
1 unter 1.000.000.000 |
|
ppt (parts per trillion) amerikanisch |
pmol / mol = 10-12
(pikomol / mol) |
1 unter 1.000.000.000.000 |
|
Verteilung
Abhängig von örtlichen und zeitlichen Bedingungen kann ein Gas in der Atmosphäre unterschiedlich verteilt sein:
|
 |
 |
|
1. a) gleichmäßig (homogen) verteilt
(z.B. Stickstoff, Sauerstoff, Kohlendioxid)
Bild: Elmar Uherek
|
|
 |
 |
 |
|
b) ungleichmäßig (inhomogen) verteilt
(z.B. Wasserdampf, Ozon, viele weniger bedeutende Spurengase)
|
|
|
Homogen verteilt bedeutet, dass wir vergleichbare Mischungsverhältnisse des Gases überall rund um den Globus und in verschiedenen Höhen finden. Dies ist der Fall, wenn die Gase stabil sind und eine lange Lebensdauer haben. Sie werden nur langsam aus der Atmosphäre entfernt und reagieren nicht oder nur ganz allmählich.
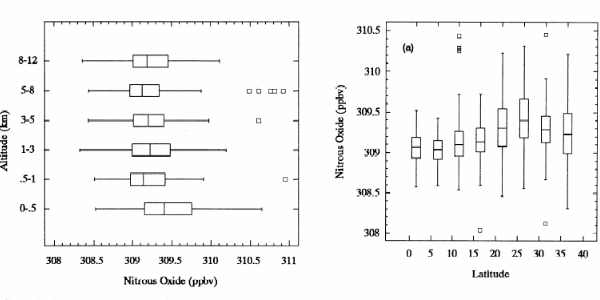
Beispiel: Distickstoffmonoxid N2O |
 |
 |
|
2. Verteilung von Distickstoffmonoxid in der Atmosphäre. Die Messung erfolgte über dem Pazifischen Ozean in verschiedenen Höhen und über viele Längengrade hinweg. Die Darstellung zeigt auch die Fehlerbalken. Die Einheit ppbv steht für den Volumenanteil des Gases am Gesamtvolumen der Luft.
Quelle: J.E. Collins et al., Journal of Geophysical Research, 101, D1 (1996) S. 1975-84
|
Distickstoffmonoxid N2O ist ein gleichmäßig verteiltes Gas. Sein Anteil in der Luft ist jedoch über die letzten 200 Jahre stetig gestiegen, vor allem auf Grund vom Menschen verursachter Beiträge.
3. Diagramm: Elmar Uherek
|
 |
|
 |
 |
|
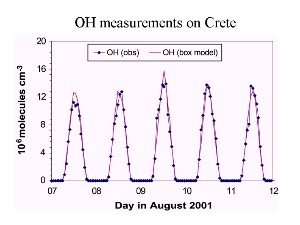
4. Zeitprofil der OH-Konzentration
Quelle: Vortrag J. Lelieveld, MPI for Chemistry, Mainz 2003
|
|
 |
Zeitliche Entwicklung
Das Auftreten von Gasen kann stark an die Sonnenstrahlung gebunden sein, wenn sie in chemische Prozesse involviert sind, bei denen Photolyse (Spaltung durch Licht) eine Rolle spielt. In diesem Fall haben sie einen 'Tagesgang', manchmal auch einen Jahresgang.
Tagesgang: Beispiel Hydroxyl-Radikal OH
OH zum Beispiel hängt vom Sonnenlicht ab. Seine Menge steigt über den Tag hinweg an und fällt während der Nacht wieder ab, wie in der Einheit 'Oxidation' beschrieben.
|
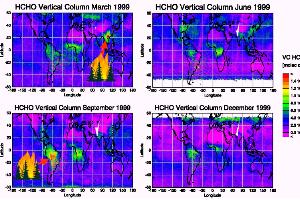
Jahreszeitliche Veränderungen: Beispiel Formaldehyd
Formaldehyd HCHO ist ein Gas, das z.B. bei Vegetationsfeuern gebildet wird. Die Beobachtungen vom satellitengestützten GOME-Instrument zeigen, dass die Konzentration während der Waldbrandsaison hoch ist (März in Südost-Asien, September in Brasilien).
|
 |
 |
 |
|
5. Formaldehyd - Gesamtmenge über die Luftsäule, beobachtet aus dem Weltall
© IUP Bremen / ESA - GOME
Bitte zum Vergrößern anklicken! (110 K)
|
|
|
Die Konzentrationen einiger Gase steigen oder fallen langfristig über Jahrzehnte, über Hunderte, Tausende oder sogar Millionen von Jahren. Die menschliche Aktivität ließ die Mengen vieler Gase insbesondere über die letzten 200 Jahre seit dem Beginn der Industrialisierung ansteigen, wie für N2O schon gezeigt wurde.
|
 |
 |
|
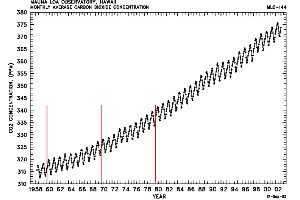
6. Trend in des CO2-Mischungsverhältnisses, gemessen am Mauna Loa Observatorium auf Hawaii
Diagramm: © CDIAC US Department of Energy
Bitte für eine vergrößerte Ansicht anklicken! (70 K)
|
|
 |
Wachstumszeiten und menschlicher Einfluss: Beispiel Kohlendioxid (CO2)
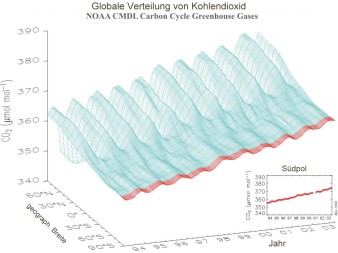
Kohlendioxid ist ein ausgezeichnetes Beispiel, um die weltweite Verteilung eines Gases zu studieren. Es ist relativ stabil und verteilt sich gleichmäßig über die ganze Erde. Wir wissen aber auch: Durch die menschliche Aktivität steigt die Menge an Kohlendioxid in der Luft über die Jahre immer weiter an, wie die Abbildung links zeigt. Der Großteil des CO2 wird auf der Nordhalbkugel gebildet, da hier die größere Landmasse ist und hier weit mehr Menschen leben, die Energie verbrauchen (Europa, die USA, China, Indien ...).
|
 |
 |
|
7. Weltweite CO2-Verteilung und ihre jährliche sowie mittelfristige Änderung
© NOAA / CMDL
Bitte zum Vergrößern anklicken! (90 K)
|
|
 |
Kohlendioxid steigt daher zunächst auf der Nordhalbkugel an und dringt danach allmählich auch in den Süden vor. Der Transport über den Äquator ist langsam, da die Durchmischung innerhalb einer Erdhalbkugel weit schneller erfolgt als die Durchmischung zwischen den Hemisphären.
Wir machen aber noch eine zweite Beobachtung: Das Jahresmuster von CO2 variiert. Im Winter stellen Bäume und andere Pflanzen das Wachstum ein. Die Aufnahme von CO2 sinkt. Gleichzeitig beginnen wir unsere Häuser zu beheizen und emittieren mehr CO2. Folglich haben wir die höchsten CO2-Werte am Ende der Heizperiode im Mai. Etwa 5 ppm weniger sind es am Ende der Wachstumsperiode, während der die Pflanzen CO2 verbrauchen. Die beiden Diagramme zeigen klar dieses Muster.
|
About this page:
Author: Elmar Uherek - Max Planck Institute for Chemistry, Mainz
Scientific reviewer: Dr. Rolf Sander - Max Planck Institute for Chemistry, Mainz - 2004-05-18
Letzte Überarbeitung: 2007-08-22
|
|
 |
|







