|
|
 |
|
|
|
 |
| |
|
|
 |
Untere Atmosphäre
Mehr .. |
Verteilung & Konzentration (2)
Möchten wir etwas über die Konzentrationen von weniger stabilen Verbindungen in der Atmosphäre erfahren, so können wir nicht einfach eine Zahl angeben. Sie hängen stark von der Chemie ab, die sich in der Luft abspielt.
|
|
|
|
|
 |
Vertikales Profil
Nicht nur die horizontale Verteilung von Gasen kann in Abhängigkeit von Quellen, Senken und physikalischen Größen wie Sonnenschein, Temperatur, Niederschlag und Wind variieren. Viele Gase zeigen auch eine vertikale Verteilung, meist mit leicht sinkenden Mischungsverhältnissen mit zunehmender Höhe. Dies gilt besonders jenseits der Tropopause und in den ersten zwei Kilometern der planetaren Grenzschicht, die stark unter dem Einfluss der Erde steht, bis zur freien Troposphäre. Eine Ausnahme macht Ozon, das seine höchsten Mischungsverhältnisse in der Stratosphäre (Ozonschicht) erreicht. Wir müssen jedoch nicht so hoch gehen. Die meiste Chemie findet in der Grenzschicht nahe dem Erdoberfläche statt, wo auch die meisten Verbindungen emittiert werden.
In den Grafiken unten sehen wir verschiedene Höhenprofile von organischen und anorganischen Spurengasen, die von einem Forschungsflugzeug aus gemessen wurden. Abgesehen von Kohlenmonoxid, Ozon und Methan sind die typischen Mischungsverhältnisse einige hundert ppt oder einige wenige ppb. Die hier beobachteten Gase sind aber nur die wichtigsten. Es gibt hunderte anderer Chemikalien, die in Mischungsverhältnissen von nur einigen ppt auftreten.
|
 |
 |
 |
|
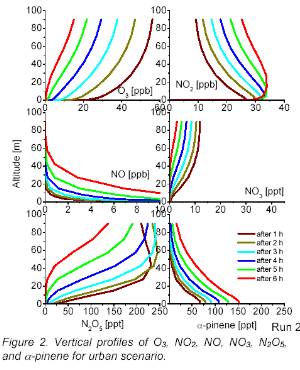
1. Änderung der Konzentration verschiedener Substanzen in Bodennähe während der Nacht. Die Kurven sind keine Messwerte, sondern Ergebnisse eines Modells. Dieses erlaubt es, Änderungen in Abhängigkeit von der Zeit darzustellen, wie sie in verschiedenen Farben gezeigt sind.
Autoren: Andreas Geyer, Shuihui Wang und Jochen Stutz
Zum Vergrößern bitte anklicken!
|
|
|
|
 |
Gemessene Verbindungen:
CH4 = Methan
CO = Kohlenmonoxid
CH3OH = Methanol
CH3COCH3 = Aceton
HCHO = Formaldehyd
|
|
|
 |
O3 = Ozon
NO = Stickstoffmonoxid
NOy = oxidierte Stickstoffverbindungen ohne NO, NO2
PAN = Peroxyacetylnitrat
CN = Wolkenkeime (Partikel) - condensation nuclei
|
 |
 |
|
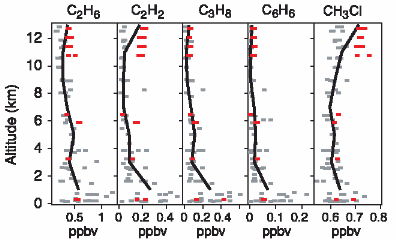
2. a-c) Höhenprofile verschiedener organischer und anorganischer Gase
Die Werte wurden in einem Forschungsflugzeug über dem Mittelmeer im August 2001 gemessen. Die dicke schwarze Linie zeigt das mittlere Höhenprofil, die dünneren schwarzen Linien die Standardabweichung. Graue Rechtecke sind Proben aus Kanistern. Die rot gestrichelten Linien und roten Rechtecke sind Daten eines anderen Fluges. Sie geben eine Vorstellung, wie stark die Werte innerhalb weniger Tage schwanken können.
Jede vergrößerte Ansicht hat etwa 16 kB. Klicke auf das Bild!
Daten und Grafiken: J. Lelieveld und Koautoren
|
|
 |
C2H6 = Ethan
C2H2 = Acetylen = Ethin
C3H8 = Propan
C6H6 = Benzol (Benzen)
CH3Cl = Methylchlorid
|
Gase in der Troposphäre
Einen Überblick über die Spurengase in der Troposphäre und ihre Konzentrationen zu geben, ist kaum möglich. Dieselbe Verbindung kann in extrem niedriger Konzentration anwesend sein, z.B. über den Ozeanen, oder in sehr hoher Konzentration, z.B. im städtischen Raum. Auch kann man sicherlich einige Dutzend Gase als wichtig einstufen. Die folgende Tabelle kann daher nur als eine Zusammenstellung von oft gemessenen Verbindungen angesehen werden, für die ein realistisches Mischungsverhältnis (gewöhnlich in Bodennähe) angegeben ist.
|
|
Überblick wichtiger Gase in der freien Atmosphäre:
|
Name |
Formel |
Mischungsverh. |
Stickstoff |
N2 |
78,08 % |
Sauerstoff |
O2 |
20,95 % |
Argon |
Ar |
0,93 % |
Wasserdampf |
H2O |
0,1 - 4 %
= 1.000 - 40.000 ppm |
Kohlendioxid |
CO2 |
385 ppm* |
Kohlenmonoxid |
CO |
50 - 200 ppb |
Methan |
CH4 |
1,7-1,8 ppm* |
Wasserstoff |
H2 |
0,5 ppm
(480 - 540 ppb) |
Ozon |
O3 |
10 -100 ppb
troposph. Mittel: 34* ppb |
Hydroxyl-Radikal |
OH |
< 0,01 - 1 ppt |
Stickstoffdioxid |
NO2 |
1 - 10 ppb |
Stickstoffmonoxid |
NO |
0,1 - 2 ppb |
Distickstoffmonoxid |
N2O |
320 ppb* |
Nitrat-Radikal |
NO3 |
5 - 450 ppt |
Salpetersäure |
HNO3 |
0,1-50 ppb |
Ammoniak |
NH3 |
< 0,02 - 100 ppb |
Schwefeldioxid |
SO2 |
1 ppb (Hintergrund)
1 ppm (verschmutzte Luft) |
Formaldehyd |
HCHO |
0,5 - 75 ppb |
Ameisensäure |
HCOOH |
< 20 ppb |
Aceton |
CH3COCH3 |
0,1 - 5 ppb |
Isopren |
C5H8 |
< 1 - 50 ppb |
Monoterpene |
- |
< 100 ppt |
Carbonylsulfid |
COS |
500 +/- 50 ppt |
CFC11 |
CCl3F |
251* ppt |
CFC12 |
CCl2F2 |
538* ppt | |
*Gase, deren Mischungsverhältnis auf Grund menschlichen Eintrags ansteigt, die aber global relativ gut durchmischt sind. Die Angabe der Hauptgase bezieht sich auf trockene Luft. Daten von 2005 - 2007.
|
Mischungsverhältnisse, Konzentrationen und verschiedene Einheiten:
Die Menge an Gasen wird oft in verschiedenen Einheiten angegeben:
Konzentrationen: Moleküle/cm3 oder µg/m3
oder Mischungsverhältnisse: ppt (pmol/mol), ppb (nmol/mol), ppm (µmol/mol), % (10 mmol/mol)
Mischungsverhältnisse sind für die Wissenschaftler oft deshalb die günstigere Wahl, weil sich Luft, die aufsteigt, ausdehnt. Das Volumen wächst und damit ändert sich die Konzentration. Das Verhältnis der Gasmengen zueinander jedoch, das Mischungsverhältnis, bleibt im selben Luftpaket gleich.
Die Umrechnung von der einen Einheit in die andere hängt vom Druck ab (= von der Höhe) und vom Molekulargewicht. Nehmen wir die Rechnung für Normaldruck an der Erdoberfläche vor (etwa 1 bar), so können wir die Gesamtmenge an Molekülen per Luftvolumen wie folgt ausdrücken:
1 Mol eines Gases enthält 6x1023 Moleküle und nimmt (bei Normbedingungen) das Volumen von 22,4 L ein. Demnach sind enthalten in
1 cm3 : 2,7x1019 Moleküle
1 dm3 = 1 L : 2.7x1022 Moleküle
1 m3 : 2,7x1025 Moleküle
Beispiel für eine Abschätzung:
2 µg/m3 = 2x10-6 g/m3 NO2 ist ein typischer Wert für eine Stickstoffdioxid-Konzentration in nichtstädtischer Luft.
Molekulargewicht M(NO2) = 46 g/mol
Das bedeutet: 2x10-6 g/m3 = 4.3x10-8 mol/m3 = 2,6x1016 Moleküle/m3
Damit ist das Mischungsverhältnis in Näherung: 2,7x1016 / 2,7x1025 = 10-9 = 1 ppb
Da Ozon eine sehr ähnliche Molmasse hat, nämlich M(O3) = 48 g/mol, können wir auch sagen
2 µg/m3 Ozon = 1 ppb
Diese Rechnung ist für die Erdoberfläche gültig, auf der wir leben. In der Stratosphäre müssten wir anders rechnen, da 1 mol = 22,4 L nicht mehr gilt. Für den Ozonsmog in unseren Städten aber gilt etwa:
120 µg/m3 = 60 ppb -> hohe Werte
240 µg/m3 = 120 ppb -> sehr hohe Werte, kein Sport!, Gesundheitsrisiko!
360 µg/m3 = 180 ppb -> extrem hohe Werte, sehr ungesund für die Lungen, bleibe zuhause!
|
About this page:
Author: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz
Scientific reviewer: Dr. Rolf Sander - Max Planck Institute for Chemistry, Mainz - 2004-05-18
Letzte Überarbeitung: 2007-08-22
|
|
 |
|







