|
 От двухокиси серы до сернистой кислоты От двухокиси серы до сернистой кислоты
Если двухокись серы растворить в воде, получаем слабый раствор кислоты или так называемую сернистую кислоту.
H2O + SO2 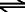 H2SO3 H2SO3
В воде сернистая кислота формирует ион (протон) водорода H+(aq) – произвольное количество, и два вида водородных сульфит анионов:
H2SO3 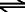 H+(aq) + HSO3-(aq) H+(aq) + HSO3-(aq)
Водородный сульфит формирует ион водорода H+ и сульфит анион.
HSO3-(aq) 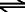 H+(aq) + SO32-(aq) H+(aq) + SO32-(aq)
Водородный сульфит содержит ион водорода H+ и сульфит анион.
Из каждой молекулы сернистой кислоты могут быть получены два протона. Поэтому сернистую кислоту называют бипротоновой кислотой. Однако, сернистая кислота – непостоянная кислота. Уже при нормальной комнатной температуре она вновь переходит в двухокись серы и воду.
 Серная кислота Серная кислота
При сгорании серы и в течение окислительных реакций в воздухе формируется не только двухокись, но и трехокись серы. Образованное количество каждого из этих газов строго зависит от температуры, так как трехокись серы распадается на двухокись серы и кислород при температуре выше 600°C:
2 SO3 -> 2 SO2 + O2 (at t > 600°C)
Если трехокись серы распадается в воде, формируется серная кислота:
SO3 + H2O 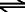 H2SO4 H2SO4
Серная кислота также является бипротоновой кислотой, которая разлагается в воде на два иона и анион.
H2SO4 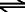 H+(aq) + HSO4-(aq) H+(aq) + HSO4-(aq)
Вначале серная кислота формирует ионы водорода и водородный сульфат анион.
HSO4-(aq) 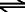 H+(aq) + SO42-(aq) H+(aq) + SO42-(aq)
Водородный сульфат разлагается, чтобы выделить другой ион водорода и сульфат анион.
|







