|
|
 |
|
|
|
 |
| |
|
|
 |
Untere Atmosphäre
Mehr |
Nächtliche Bedingungen und Chemie
Die Chemie, die in der Atmosphäre stattfindet, hängt nicht nur davon ab, welche Verbindungen in sie entlassen werden, sondern auch davon, welche Bedingungen in ihr herrschen. Letztere sind durch die Jahreszeiten bestimmt, durch den Wechsel von Tag und Nacht, durch Temperaturprofile, durch die Feuchte und anderes mehr.
|
|
|
|
|
 |
 |
 |
|
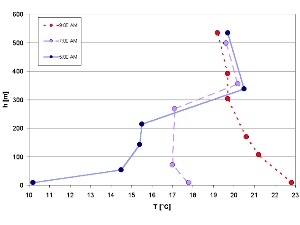
1. Eine sich auflösende Temperaturinversion an einem Morgen im Juli (gemessen im Isartal / Deutschland)
Umgewandelt von Elmar Uherek aus: Schirmer - Wetter und Klima - Wie funktioniert das?
Bitte zum Vergrößern anklicken! (50 K)
|
|
 |
Tageszyklus
Im vorhergehenden Text erfuhren wir einiges über den Tageszyklus von OH, der vom Sonnenlicht abhängt. Nicht nur die chemischen Substanzen in der Atmosphäre zeigen einen solchen Zyklus, auch die Bedingungen, mit denen sie oft verbunden sind, so z.B. das Temperaturprofil. Die Bedingungen in der erdnahen Grenzschicht (Planetary Boundary Layer, PBL) ändern sich über den Tag hinweg und folgen nicht immer der Regel einer mit der Höhe abnehmenden Temperatur. Denn diese Schicht zeigt starke Wechselwirkung mit der Erdoberfläche. Ein Beispiel ist die nächtliche Inversion, die in den Morgenstunden aufgehoben wird.
|
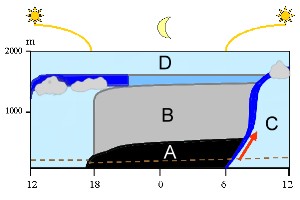
Nächtliche Inversion in der planetaren Grenzschicht
Alles, was sich an Luft unterhalb der freien Atmosphäre (D) befindet, gehört zur planetaren (erdnahen) Grenzschicht. In dieser ändern sich im Verlauf eines Tages die Bedingungen (von links nach rechts): Zum Mittag ist die Luft durchmischt (hellblau). Nach Sonnenuntergang bildet sich die stabile nächtliche Schicht aus (A) und die übrige Luft lagert über ihr (B). Die Luft der Oberflächenschicht unterhalb der gepunkteten Linie kann während der Nacht nicht in höhere Lagen aufsteigen. Hierzu fehlt die antreibende Energie. Diese wird erst wieder mit dem Sonnenaufgang verfügbar. Der Erdboden erwärmt sich, die warme (= leichtere) Luft beginnt zu steigen (roter Pfeil), die stabile Schichtung der Nacht bricht auf. Eine Luft mit sich führende Schicht (engl.: entrainment zone) steigt vom Erdboden bis in die höchsten Lagen der planetaren Grenzschicht auf (dunkelblau) und führt zu einer Durchmischung der Luft während des Tages (C).
|
 |
 |
 |
|
2. Modell der planetaren Grenzschicht. Die Dicke der Schicht kann variieren.
Grafik umgestaltet von Elmar Uherek, Vorlage: Stull 1988
Zum Vergrößern bitte anklicken! (70 K)
|
|
Im Winter kann es vorkommen, dass die Sonne über einen oder auch mehrere Tage nicht stark genug ist, die Inversionsschicht aufzulösen. In solchen Fällen sammeln sich die Abgase und Verschmutzungen über den Städten und führen zu Smog. Besondere Bedingungen findet man auch oft in Gebirgstälern, wie auf dem Photo rechts gezeigt. Die Inversion bleibt unterhalb einer Wolkendecke bestehen.
|
 |
 |
 |
|
3. Winterliche Inversionsschicht in den Bergen
© Inst. für Didaktik der Geographie, Univ. Erlangen-Nürnberg
|
|
 |
 |
|
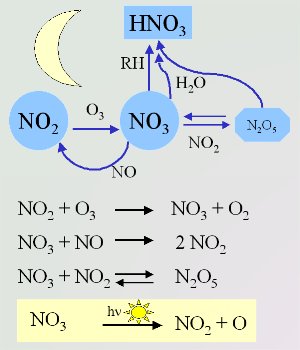
4. Wichtige Nitrat-Reaktionen in der Nacht (Photolyse am Tag im gelben Kasten)
Schema: Elmar Uherek
Zum Vergrößern bitte anklicken!
|
|
 |
Nitratchemie
Auf Grund der unterschiedlichen Bedingungen während der Nacht ist auch die Chemie anders. Es gibt weniger Quellen für OH. Nitratradikale gehen stattdessen während der Nacht ähnliche Reaktionen ein, wie es OH während des Tages tut. Nitratradikale NO3 entstehen aus der Reaktion von Ozon mit Stickstoffdioxid (Basis Einheit 3). Mit NO reagieren sie wieder zurück. Daher können NO und NO3 in höheren Konzentrationen nicht gemeinsam vorhanden sein. Die Reaktion von NO2 und NO3 ist der einzige Weg in der Atmosphäre zur Bildung von Distickstoffpentoxid N2O5. Dieses kann sich in Wasser zu Salpetersäure zersetzen oder zu den Ausgangsverbindungen (Edukten) zurückreagieren.
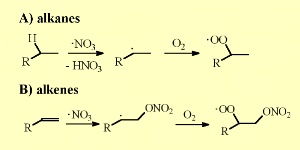
Wie auch OH, so spalten Nitratradikale von Alkanen ein H-Atom ab. Salpetersäure HNO3 und ein Alkylradikal R werden gebildet. Letzteres reagiert mit Sauerstoff und bildet Peroxyl-Radikale RO2 werden gebildet. Letzteres reagiert mit Sauerstoff und bildet Peroxyl-Radikale RO2 . .
|
NO3 addiert sich auch an die Doppelbindungen von ungesättigten organischen Verbindungen und bildet Peroxynitrate nach weiterer Reaktion mit O2.
Die Lebensdauer von NO3 / N2O5 sinkt stark mit steigendem Anteil von Wasserdampf in der Luft. HNO3 wird gebildet, insbesondere an flüssigen Filmen auf Oberflächen, mit denen das Gas in Kontakt kommt.
Alle Peroxyverbindungen, die aus den Reaktionen mit  OH, NO3 und Ozon entstehen, gehen in der Atmosphäre recht komplizierte und vielfältige weitere Reaktionen mit O2, HO2 OH, NO3 und Ozon entstehen, gehen in der Atmosphäre recht komplizierte und vielfältige weitere Reaktionen mit O2, HO2 , RO2 , RO2 , NO oder NO2 ein. Sie führen zu Alkoholen, Aldehyden, Nitraten und Carbonsäuren. Es würde weit über die Möglichkeiten dieser Klimaseite hinausgehen, all diese tausende von Reaktionen im Detail zu erläutern, die auch nur teilweise erforscht sind. , NO oder NO2 ein. Sie führen zu Alkoholen, Aldehyden, Nitraten und Carbonsäuren. Es würde weit über die Möglichkeiten dieser Klimaseite hinausgehen, all diese tausende von Reaktionen im Detail zu erläutern, die auch nur teilweise erforscht sind.
|
 |
 |
 |
|
5. Nitrat-Reaktionen mit Alkanen und Alkenen
Bitte zum Vergrößern anklicken! (30 K)
|
|
 |
 |
|
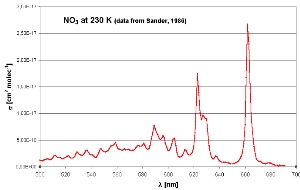
6. Das Absorptionsspektrum des Nitratradikals liegt im sichtbaren Bereich mit einem Maximum im roten Teil des Spektrums (600-700 nm)
Übernommen von Sander (1986), gemessen bei 230 K
Zum Vergrößern bitte anklicken!
|
|
 |
NO3 absorbiert Licht im roten Bereich des sichtbaren Spektrums. Sobald es am Ende der Nacht hell wird, wird es vom ersten Licht gespalten, vor allem in NO2 und O. Die OH-Chemie des Tages dominiert wieder. Ozon, das dritte wichtige Oxidationsmittel in der Atmosphäre, kann nicht mit Alkanen reagieren. Aber es ist eine Konkurrenz für OH in der Reaktion mit Alkenen, wenn es relativ dunkel ist, z.B. am Abend oder im Winter. Ein spezielles Kapitel erklärt die Ozonreaktionen näher.
|
About this page:
author: Dr. Elmar Uherek - MPI for chemistry, Mainz
scientific reviewer: Dr. Mark Lawrence - MPI for chemistry, Mainz 2004-05-05
educational proofreading: Michael Seesing - Uni Duisburg - 2003-07-02
Letzte Überarbeitung: 2007-08-21 | |
|
 |
|







