|
|
 |
|
|
|
 |
| |
|
|
 |
Haute Atmosphère
Plus |
La chimie de l'ozone stratosphérique
La découverte du trou dans la couche d'ozone en 1985 a considérablement développé les recherches sur l'ozone. Cette page est consacrée à l'historique des recherches sur la chimie de la stratosphère.
|
|
|
|
|
 |
La découverte de l'ozone et les premières mesures
Cela fait déjà assez longtemps que l'ozone est le sujet de recherches. En 1840, le chimiste Christian Friedrich Schönbein découvrit que ce gaz se formait pendant les décharges électriques, et le baptisa ozone (ce qui signifie "sentir" en grec). On découvrit rapidement que l'ozone était un composant de l'air. Schönbein lui-même développa les techniques de mesure de l'ozone, qui furent améliorées à l'Observatoire Montsouris à Paris. Ces premières données de concentrations d'ozone, entre 1876 et 1910, sont aujourd'hui le témoin des teneurs en ozone de l'atmosphère avant la révolution industrielle.
|
 |
 |
 |
|
1. Christian Friedrich Schönbein
source: Internet
|
|
 |
 |
|
2. Le spectromètre Dobson
Remerciements à : Ulf Köhler, DWD Hohenpeissenberg
Cliquez pour agrandir ! (130 K)
|
|
 |
En 1879, on découvrit que seule une très faible partie des UV-B du soleil atteignait la surface terrestre. L'année suivante les scientifiques montrèrent que l'ozone absorbait énormément ces rayons et qu'il pouvait être responsable de la filtration de ces UV-B. Cependant la quantité d'ozone présente dans la basse troposphère était trop faible pour jouer ce rôle, et on supposa avec raison que l'ozone devait se trouver essentiellement dans la haute atmosphère. |
|
Au début du 20ème siècle, des travaux très importants ont été réalisés par Gordon Dobson. Ce chercheur a développé un spectromètre Dobson qui est utilisé depuis 1929 pour mesurer l'ozone dans toute l'atmosphère, et est toujours utilisé de nos jours, même s'il est progressivement remplacé par des méthodes plus modernes.
Pour plus de détails sur la façon dont fonctionne le spectromètre Dobson, cliquez ici (en anglais).
|
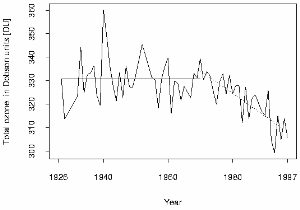
L'un des six premiers spectromètres Dobson a été utilisé à Arosa en Suisse par Paul Götz, et ces mesures représentent les plus anciennes données d'épaisseur de la couche d'ozone dans le monde. Elles attestent que même au dessus de l'Europe, cette couche s'affine de plus en plus. Des valeurs d'ozone inférieures à 300 DU ont été mesurées ces dernières années en Allemagne. En dessous de ces valeurs une protection solaire est nécessaire.
Vers 1930, Götz montra que les concentrations maximales d'ozone se situaient très certainement en dessous de 25 km. Grâce à ses travaux, la localisation de la couche d'ozone et son épaisseur furent enfin connues.
|
 |
 |
 |
|
3. Mesures d'ozone à Arosa
source: ETH Zürich
|
|
 |
 |
|
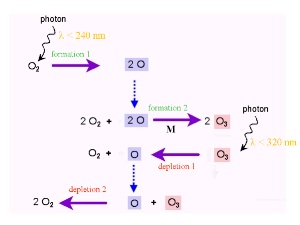
4. Les réactions de Chapman
Auteur: Elmar Uherek
Cliquez pour agrandir ! (40 K)
|
|
 |
Les réactions de Chapman
D'où vient l'ozone et quelle est la raison de sa disparition? En 1930, le britannique Sydney Chapman exposa ses théories sur la formation et la destruction chimique de l'ozone. Ces hypothèses, qui se révélèrent correctes, sont appelées le cycle de Chapman ou les réactions de Chapman.
L'atome d'oxygène et l'ozone se transforment alternativement l'un en l'autre. Les liaisons qui unissent les atomes au sein des molécules sont cassées à cause des rayons solaires. Pour briser la molécule d'O2 il faut plus d'énergie solaire que pour briser la molécule d'ozone (dans le premier cas, il faut une longueur d'onde de 240 nm contre 320 nm dans le second cas).
|
|
La formation et la destruction de l'ozone sont en équilibre et la réaction dont le bilan est nul est la suivante:
3 O2 -> 2 O3 et 2 O3 -> 3 O2 |
Absorption des UltraViolets
Les liaisons qui maintiennent les atomes entre eux dans les molécules sont plus ou moins fortes, il faut donc plus ou moins d'énergie pour les casser. L'énergie des rayons du soleil est fonction de leur longueur d'onde. La liaison entre les deux atomes d'oxygène dans la molécule d'oxygène (O2) est si forte qu'elle ne peut se casser que si la molécule absorbe des UV-C très énergétiques. La liaison entre les atomes d'oxygène dans la molécule d'ozone est un peu moins forte, et peut être cassée lorsque l'ozone absorbe des UV-B qui sont un peu moins énergétiques. L'absorption des ces longueurs d'onde courtes et très énergétiques par l'ozone et l'O2 se faisant dans la haute atmosphère, il n'arrive sur la surface terrestre que les longueurs d'ondes plus grandes.
|
 |
 |
 |
|
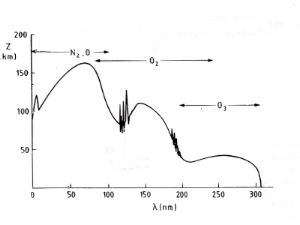
5. Spectre d'absorption:
Ce schéma montre quels composés atmosphériques absorbent quelles radiations solaires. L'axe à gauche représente l'altitude où la lumière solaire est absorbée. La lumière de longueur d'onde inférieure à 200 nm est arrêtée dans la ionosphère et la mésosphère (au dessus de 50 km) par le diazote N2, les atomes d'oxygène O et le dioxygène O2. La lumière entre 200 et 320 nm descend jusque dans stratosphère (en dessous de 50 km), où elle est absorbée par l'ozone O3. Finalement, seule la lumière de longueur d'onde supérieure à 320 nm atteint la surface terrestre.
|
|
La diminution de l'ozone par certains composés
Les concentrations d'ozone observées ne peuvent être expliquées par les seules réactions de Chapman. Depuis 1970, les recherches menées sur la chimie de l'ozone ont montré que les oxydes d'azote et certains composés halogénés (c'est à dire contenant du chlore, du fluor, de l'iode ou du brome) réagissaient avec l'ozone. Les scientifiques Crutzen, Molina, et Rowland ont obtenu le prix Nobel en 1995 pour ces travaux.
|
 |
 |
 |
|
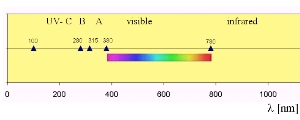
6. Spectre électromagnétique de la lumière
La lumière solaire est classée suivant les longueurs d'onde des radiations (ultraviolettes, visibles, infrarouges). Par exemple, les ultraviolets A sont compris entre 315 et 380 nm (néanmoins, ils sont parfois classés entre 315 et 400 nm).
Auteur: Elmar Uherek. Cliquez pour agrandir! (60 K)
|
|
 |
 |
|
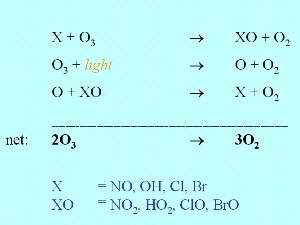
7. Destruction chimique de l'ozone
Cliquez pour agrandir ! (40 K)
|
|
 |
L'ozone n'est pas seulement détruit par les ultraviolets du soleil, mais aussi parce qu'il réagit avec des composés tels que l'oxyde d'azote NO, le composé OH ou les atomes halogénés tels que Cl ou Br.
Lorsque les humains ont commencé à rejeter dans l'atmosphère des gaz halogénés, certains scientifiques avaient prédit que les concentrations d'ozone risquaient de baisser. Cependant personne n'avait jamais imaginé qu'il se formerait un jour un tel trou dans la couche d'ozone avant sa découverte en Antarctique en 1985.
|
A propos de cette page:
auteur: Elmar Uherek - MPI Mainz
relecteur pédagogique : Michael Seesing - Uni Duisburg - 07.08.2003
dernière version: 12.01.2004
|
|
 |
|







