|
|
 |
|
|
|
 |
| |
|
|
 |
Haute Atmosphère
Plus |
Chimie du Chlore
La production en masse de chlorofluorocarbons (CFC) a engendré l'émission de chlore dans l'atmosphère. Or ces molécules chlorées sont les pires ennemies de l'ozone. Mais pour détruire la couche d'ozone, il fallait que de multiples conditions très particulières soient réunies, et c'est à cause de cela que personne n'a vu arriver ce bouleversement dramatique...
|
|
|
|
|
 |
 |
 |
|
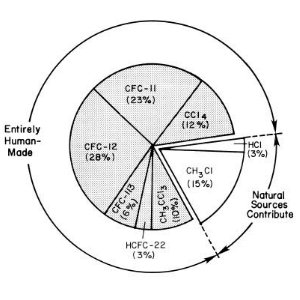
1. Sources du chlore pénétrant dans la stratosphère au début des années 1990
source: UNEP/WMO Scientific Assessment of Ozone Depletion
|
|
 |
Les gaz CFCs n'ont pas de source naturelle
Les pires ennemis de l'ozone sont le CFC-11 (CFCl3), le CFC-12 (CF2Cl2), et le CFC-113 (CF2ClCFCl2). On sait maintenant grâce aux mesures atmosphériques aux pôles que ces composés n'ont aucune source naturelle. La seule source naturelle significative de chlore est le méthylchloride CH3Cl, et ce composé a une durée de vie comparativement courte (1,3 ans).
En raison de leur stabilité face au radical OH et à la photolyse dans la troposphère, les CFCs ont une vie troposphérique très longue, de l'ordre de 50 à 100 ans. Ils atteignent la stratosphère et y sont photolysés, ce qui conduit à la formation de radicaux de chlore. La présence de ces radicaux ne mène pas nécessairement à une baisse significative de l'ozone, car d'autres réactions entrent en concurrence. Des conditions particulières sont nécessaires, comme on va le voir.
|
Les conditions particulières du trou d'ozone en Antarctique
Durant la nuit polaire, la température de l'air peut descendre jusqu'à -80 °C. Dans ces conditions, le peu d'eau et d'acide nitrique présents dans la stratosphère gèlent (donnant du trihydrate d'acide nitrique) et des nuages stratosphériques polaires glacés se forment. Cinq conditions essentielles peuvent maintenant survenir en même temps:
|
 |
 |
|
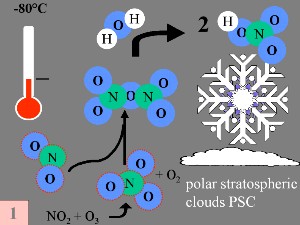
3. a-d) Conditions particulières et réactions chimiques dans la formation du trou d'ozone. Images par Elmar Uherek; Taille normale: 50-100 K
|
|
 |
Premièrement: Le monoxyde d'azote NO et le dioxyde d'azote NO2, (qui permettent de convertir le ClO en en HCl, comme on l'a vu ci-dessus), sont éliminés de la phase gazeuse stratosphérique par les réactions suivantes: en en HCl, comme on l'a vu ci-dessus), sont éliminés de la phase gazeuse stratosphérique par les réactions suivantes:
 NO + O3 -> NO + O3 ->  NO2 + O2 NO2 + O2
 NO2 + NO2 +  NO3 + M* -> N2O5 + M NO3 + M* -> N2O5 + M
N2O5 + H2O -> 2 HNO3
Le produit de la réaction est l'acide nitrique HNO3 qui s'incorpore dans les nuages stratosphériques polaires (PSC).
|
|
|
 |
Deuxièmement: HCl et ClONO2 réagissent l'un avec l'autre à la surface des nuages stratosphériques polaires, pour donner Cl2 et HNO3. Cet acide nitrique est immédiatement incorporé dans les particules de glace du nuage.
Quatrièmement: S'il n'y a aucun oxyde d'azote en présence, les radicaux de chlore commencent des réactions en chaîne, qui mènent à la destruction de l'ozone.
|
|
|
 |
Cinquièmement: Normalement des espèces chlorées comme Cl , ClO , ClO , et Cl2O2 se forment et se concentrent dans la partie supérieure de la stratosphère, alors que l'ozone se trouve plutôt dans la basse stratosphère. Les experts ont d'abord pensé que l'ozone et les produits chimiques qui le détruisent ne devraient se rencontrer qu'à la frontière de ces zones. On ne s'attendait donc pas à ce que les niveaux d'ozone diminuent de manière significative bien que les concentrations de composés contenant du chlore aient augmenté dans la stratosphère. Cependant, personne n'avait pris en compte le vortex polaire. Ce vortex météorologiquement stable (vent circumpolaire) ayant le pôle plus ou moins en son centre, transporte l'air riche en chlore de la stratosphère supérieure vers la stratosphère inférieure, riche en ozone, ce qui permet la destruction importante de l'ozone. , et Cl2O2 se forment et se concentrent dans la partie supérieure de la stratosphère, alors que l'ozone se trouve plutôt dans la basse stratosphère. Les experts ont d'abord pensé que l'ozone et les produits chimiques qui le détruisent ne devraient se rencontrer qu'à la frontière de ces zones. On ne s'attendait donc pas à ce que les niveaux d'ozone diminuent de manière significative bien que les concentrations de composés contenant du chlore aient augmenté dans la stratosphère. Cependant, personne n'avait pris en compte le vortex polaire. Ce vortex météorologiquement stable (vent circumpolaire) ayant le pôle plus ou moins en son centre, transporte l'air riche en chlore de la stratosphère supérieure vers la stratosphère inférieure, riche en ozone, ce qui permet la destruction importante de l'ozone.
|
Ces cinq conditions doivent survenir ensemble pour former le trou d'ozone. C'est pourquoi la majeure zone de destruction de l'ozone se situe au-dessus des pôles (principalement le pôle Sud) et uniquement au printemps, dès que le soleil réapparaît après l'hiver polaire.
Lorsque l'année avance et que la température de l'air augmente, les nuages polaires fondent, les oxydes d'azote redeviennent à nouveau disponibles, le vortex s'affaiblit, ce qui limite le transport des espèces chlorées réactives vers la basse stratosphère et la couche d'ozone se reconstitue.
|
 |
 |
 |
|
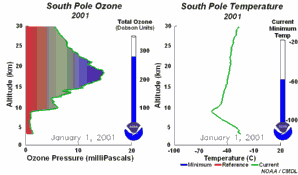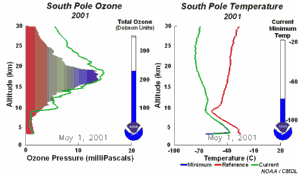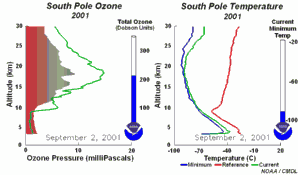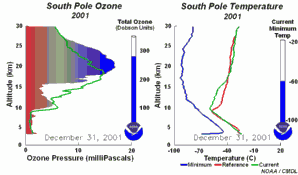
4. Le développement du trou d'ozone en 2001. Cliquez pour agrandir et voir une séquence de 5 jours (270 K)! L'animation originale provient de the NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado.
|
|
M: Dans toute réaction A + B - > C un troisième composé est nécessaire, pour emporter l'excès d'énergie. Sinon, le produit C aurait la même énergie que la somme des réactifs A + B et la réaction inverse se déroulerait tout de suite. Dans la plupart des cas M est le dioxyde d'azote (N2) de l'air.
|
A propos de cette page:
auteur: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz, Germany
relecteur scientifique: Dr. Christoph Bruhl - Max Planck Institute for Chemistry, Mainz
relecteur pédagogique: Michael Seesing - Uni Duisburg - 2003-08-07
dernière version :11.05.2004
|
|
 |
|







