|
|
 |
|
|
|
 |
| |
|
|
 |
Alta Atmosfera
Approfondimento |
La chimica del cloro
La produzione industriale di clorofluorocarburi (CFC) e il loro utilizzo hanno introdotto una nuova fonte di cloro nell'atmosfera. Poiché la chimica del cloro è la principale responsabile della distruzione dell'ozono, i CFC hanno avuto conseguenze fatali per lo strato dell'ozono. Eppure, poiché le condizioni richieste per la formazione del buco dell'ozono sono molto inusuali, nessuno aveva previsto quanto questi composti potessero essere dannosi.
|
|
|
|
|
 |
 |
 |
|
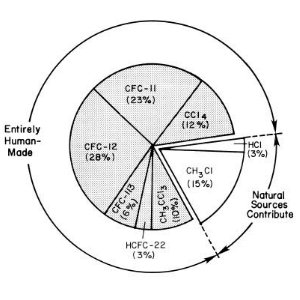
1. Fonti primarie di cloro immesso nella stratosfera nei primi anni '90. fonte: UNEP/WMO Scientific Assessment of Ozone Depletion.
Cliccare per allargare!
|
|
 |
CFC - gas che non esistono in natura
I gas che distruggono l’ozono e che possiedono le maggiori potenzialità di alterare il clima sono CFC-11 (CFCl3), CFC-12 (CF2Cl2) e CFC-113 (CF2ClCFCl2). È stato dimostrato chiaramente, tramite misure effettuate nell’aria intrappolata nel firn (neve), che non esistono fonti naturali di questi composti. La sola fonte naturale di cloro significativa è il metilcloruro (CH3Cl), composto che ha un'emivita relativamente breve, di solo 1,3 anni, rispetto ai 50 - 100 anni dei CFC. Poiché in troposfera i CFC non sono distrutti né dal radicale ossidrile né dalla luce solare, possono raggiungere facilmente la stratosfera. Un volta nella stratosfera, sono distrutti dalla radiazione ultravioletta ad alta energia proveniente dal sole per formare radicali di cloro reattivi. La produzione di questi radicali non porta necessariamente alla deplezione dell'ozono, e solo in condizioni particolari i radicali cloro causano una perdita di ozono significativa. |
Chimica del cloro stratosferico - concetti base
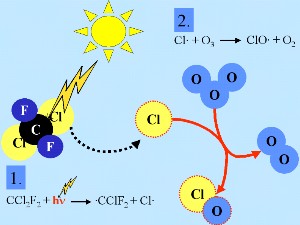
Generalmente, così come per molti altri radicali (indicati con X nell'esempio qui sotto), nella stratosfera i radicali cloro (Cl) sono ossidati dall'ozono per formare XO (ClO)
X + O3 -> XO + O2
O3 + luce solare -> O + O2
O + XO -> X + O2
netto: 2 O3 -> 3 O2
Queste reazioni a catena determinano la deplezione dell'ozono.
|
 |
 |
 |
|
2. a) Chimica di base del cloro nella stratosfera. Le linee tratteggiate rosse intorno alle specie chimiche significano che si tratta di radicali. Cliccare per allargare (50-100 kB).
|
|
Il radicale iniziale X (qui Cl) non è necessariamente riciclato e Cl o ClO possono essere anche rimossi da altre reazioni.
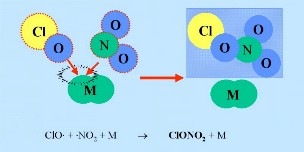
Gli ossidi di azoto possono reagire con ClO per formare i cosiddetti "serbatoi" HCl e ClONO2 (mostrati nella figura dentro un riquadro blu scuro). Per assorbire l'energia in eccesso è necessario come partner della reazione un composto inerte (M).
|
 |
 |
 |
|
2. b) e.g. M = N2
|
|
ClO + NO2 + M -> ClONO2 + M
e
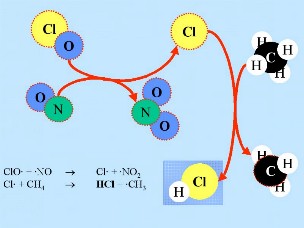
ClO + NO -> Cl + NO2
Cl + CH4 -> HCl + CH3
HCl and ClONO2 sono chiamati serbatoi perché il cloro che contengono non è reattivo, pertanto non reagiscono con l'ozono. Normalmente si trovano in fase gassosa e sono rimossi dalla stratosfera molto lentamente. Dalla chimica della stratosfera in fase gassosa ci si attenderebbe quindi solo una leggera deplezione dell'ozono. Tuttavia, durante l’ inverno, le specie serbatoio sono trasportate nella bassa stratosfera come conseguenza di una particolare circolazione atmosferica.
|
 |
 |
 |
|
2. c)
|
|
Le condizioni peculiari durante il buco dell'ozono sopra l’Antartide
Durante la notte polare, le temperature dell'aria scendono fino a -80 °C. In queste condizioni, le piccole quantità di acqua e acido nitrico presenti nella stratosfera congelano (per dare acido nitrico triidrato) e formano le nuvole di ghiaccio stratosferiche polari. A questo punto si possono verificare contemporaneamente cinque condizioni chiave:
|
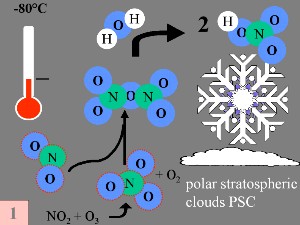 |
 |
|
3. a-d) Condizioni speciali e chimica durante la formazione del buco dell'ozono.
Immagine di Elmar Uherek; Grandezza intera: 50-100 KB
|
|
 |
Primo: l'ossido di azoto NO e il biossido di azoto NO2, (che aiutano a trasformare ClO in HCl, come mostrato sopra), sono rimossi dalla fase gassosa stratosferica attraverso le reazioni:
NO + O3 -> NO2 + O2
NO2 + NO3 + M* -> N2O5 + M
N2O5 + H2O -> 2 HNO3
Il prodotto finale è acido nitrico (HNO3), che è incorporato nelle nuvole stratosferiche polari (PSC). |
|
|
 |
Secondo: HCl e ClONO2 reagiscono tra loro sulla superficie delle nuvole stratosferiche polari per produrre Cl2 e HNO3. Quest'ultimo è immediatamente incorporato nelle particelle di ghiaccio delle nuvole.
Terzo: quando il sole sorge alla fine dell'inverno polare, Cl2 è colpito dalla radiazione solare generando due radicali cloro (Cl). |
|
|
 |
Quarto: Se non sono presenti ossidi di azoto, i radicali cloro iniziano una catena di reazioni catalitiche che portano alla distruzione dell'ozono.
Cl + O3 -> ClO + O2
Cl + O3 -> ClO + O2
ClO + ClO + M -> Cl2O2 + M
Cl2O2 + Sole -> Cl +ClO2 -> 2 Cl + O2
Netto: 2 O3 -> 3 O2 |
|
|
 |
Quinto: normalmente le specie del cloro, come Cl, ClO e Cl2O2, si formano e si concentrano nell'alta stratosfera mentre l'ozono si trova soprattutto nella bassa stratosfera. Gli esperti pensavano che l'ozono e i composti chimici che distruggono l'ozono si sarebbero perciò trovati a contatto solo nelle zone di confine. Quindi, nonostante le concentrazioni in stratosfera dei composti contenenti cloro stessero aumentando, non ci si aspettava che i livelli di ozono calassero significativamente . Questo perché nessuno aveva considerato l’importanza del vortice polare. Questo vortice meteorologico stabile (vento circumpolare), che ha al suo centro i poli, trasporta aria ricca di cloro dall'alta stratosfera alla bassa stratosfera ricca di ozono, causando così la distruzione dell'ozono.
|
Il buco dell'ozono si forma solo se si verificano contemporaneamente le cinque condizioni sopra descritte. Per questo motivo la deplezione dell'ozono più intensa si ha solo sopra i poli (principalmente in Antartide) e solo in primavera al sorgere del sole dopo l'inverno polare.
Nei mesi successivi, quando le temperature dell'aria aumentano, le nuvole polari si sciolgono, gli ossidi di azoto diventano di nuovo disponibili, il vortice si interrompe impedendo il trasporto di specie di cloro reattivo nella bassa stratosfera e si ricrea lo strato di ozono.
|
 |
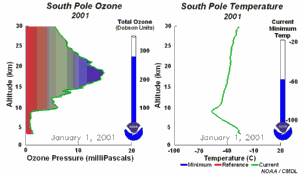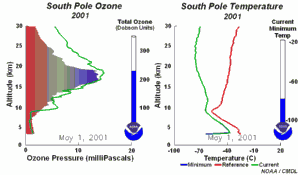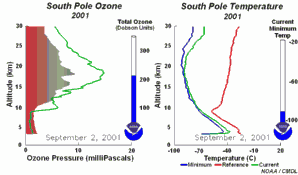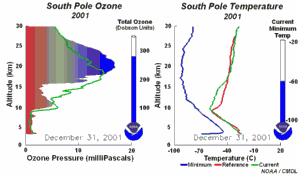 |
 |
|
4. Sviluppo del buco dell'ozono nel 2001. Cliccare per allargare per vedere la sequenza di 5 giorni (270 K)! Animazione originale fornita dal NOAA Climate Monitoring and Diagnostics Laboratory, Boulder, Colorado.
|
|
M: In ogni tipo di reazione A + B > C è necessario un terzo partner (M), che assorba l'energia in eccesso. Altrimenti il prodotto C avrebbe la stessa energia della somma dei reagenti A + B e la reazione tornerebbe indietro. In molti casi M è l’ azoto atmosferico (N2) .
|
A proposito di questa pagina:
autore: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz, Germany
revisione scientifica: Dr. Christoph Bruhl - Max Planck Institute for Chemistry, Mainz
revisione didattica: Michael Seesing - Uni Duisburg - 2003-08-07
ultima pubblicazione: 2004-05-11
|
|
 |
|







