|
|
 |
|
|
|
 |
| |
|
|
 |
Alta Atmosfera
Approfondimento |
Chimica dell'Ozono Stratosferico
La scoperta del buco dell'ozono stratosferico nel 1985, ha portato ad un enorme sviluppo della ricerca sulla chimica dell'ozono. I seguenti due capitoli ci danno una visione d'insieme della chimica della stratosfera nel suo contesto storico.
|
|
|
|
|
 |
Scoperta dell'ozono e prime misure
La ricerca sull'ozono è forse stata una delle prime nell’ambito delle scienze atmosferiche. Nel 1840 questo gas fu battezzato ozono ("che odora") dal chimico Christian Friedrich Schönbein, che fu il primo a scoprire questa sostanza che si formava durante le scariche elettriche. Poco dopo si appurò che l'ozono era un componente naturale dell'aria. Il primo metodo per misurarlo, sviluppato dallo stesso Schönbein, fu successivamente migliorato presso l'osservatorio Mount Souris a Parigi. Le prime serie temporali di dati sull'ozono (1876 - 1910) provengono da questo osservatorio e questi dati ci danno un’idea chiara di quali fossero le concentrazioni atmosferiche prima della rivoluzione industriale.
|
 |
 |
 |
|
1. Christian Friedrich Schönbein. Fonte: Webpage della Swiss Academy of Science Techniques.
|
|
 |
 |
|
2. Spettrometro Dobson.
Fonte: Ulf Köhler, DWD Hohenpeissenberg
Cliccare per allargare! (130 K)
|
|
 |
Nel 1879, fu dimostrato che solo una piccolissima quantità di radiazione solare UV-B raggiungeva la superficie terrestre. Un anno dopo, si scoprì che l'ozono assorbiva fortemente la radiazione a queste lunghezze d'onda e poteva, perciò, essere responsabile della rimozione della radiazione UV-B. La quantità di ozono nella bassa atmosfera era, tuttavia, troppo piccola per giustificare la diminuzione di UV-B che si osservava e si immaginò (correttamente) che l'ozono si trovasse anche nell’alta atmosfera. Fu però Gordon Dobson negli anni ’20 a svolgere le ricerche fondamentali sviluppando lo spettrometro Dobson che, dal 1929 a tuttoggi è utilizzato per misurare la colonna totale di ozono, anche se al momento sta per essere gradualmente rimpiazzato da strumenti più moderni.
Qui puoi leggere i dettagli su come funziona uno spettrometro Dobson:  QUI! QUI!
|
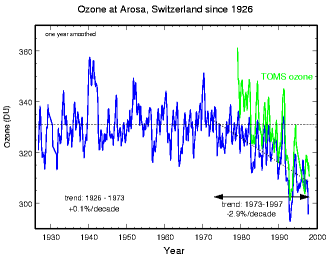
Uno dei primi sei spettrometri Dobson è stato utilizzato da Paul Götz ad Arosa in Svizzera dove abbiamo la più lunga serie temporale di misure della colonna totale di ozono nel mondo. L'andamento mostra che lo strato di ozono è diventato più sottile col tempo. Recentemente a Hohenpeissenberg in Germania sono stati misurati valori sotto le 300 UD, un limite critico che rende necessario proteggersi efficacemente dal sole. Questo è ancora più vero in primavera quando si forma un piccolo buco nell'ozono sopra l'emisfero settentrionale con valori dell'ozono che scendono fino a 200 UD. Negli anni '30, Götz mostrò che probabilmente il massimo della concentrazione dell'ozono era al di sotto della quota di 25 km: inoltre riuscì a localizzare lo strato di ozono e a misurarne lo spessore.
|
 |
 |
 |
|
3. La serie temporale dell’ ozono ad Arosa dal 1926 al 2000 (blu). A partire dal 1980 circa é possibile un confronto con le misure da satellite, (TOMS, NASA) mostrate in verde. Fonte: ETH Zürich, NASA.
Cliccare per allargare!
|
|
 |
 |
|
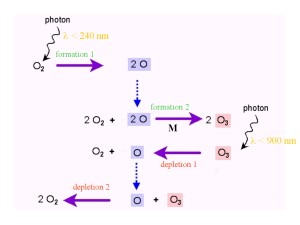
4. Le reazioni di Chapman. Schema di EU. Cliccare per allargare! (40 K)
|
|
 |
Le reazioni di Chapman
Quindi, come si produce e si distrugge l'ozono nell'atmosfera? Nel 1929 e 1930, S. Chapman pubblicò la teoria della formazione e distruzione dell'ozono. Le reazioni proposte allora si sono rivelate corrette e sono state denominate "Ciclo di Chapman" o "Reazioni di Chapman".
Queste reazioni mostrano come l'ossigeno e l'ozono si trasformano l'uno nell'altro. I legami tra gli atomi di ossigeno vengono spezzati dalla radiazione proveniente dal Sole. Per rompere il legame O-O dell'O2 è necessaria più energia (lunghezze d'onda inferiori a 240 nm) di quanta ne serva per scindere O3 (lunghezze d'onda inferiori a 900 nm). Le reazioni di formazione e distruzione dell'ozono sono in equilibrio - formazione e distruzione sono bilanciate - e il risultato netto della reazione è 'zero':
3 O2 -> 2 O3 e 2 O3 -> 3 O2
|
Assorbimento della radiazione ultravioletta
Siccome nelle molecole i legami tra gli atomi hanno forze molto diverse tra loro, per spezzarli servono quantità di energia diverse. Il legame tra due atomi di ossigeno in una molecola di ossigeno (O2) è veramente forte e può essere spezzato solo se la molecola assorbe una radiazione UV-C ad energia molto alta. I legami tra gli atomi di ossigeno nell'ozono sono un po' più deboli e possono essere spezzati dall'assorbimento di una radiazione UV-B leggermente meno energetica. Nell'alta atmosfera, L'assorbimento da parte di O2 e O3 di questa energia ad onda corta e altamente energetica, le impedisce di raggiungere la troposfera e di distruggere O2 e O3 presenti in essa.
|
 |
 |
 |
|
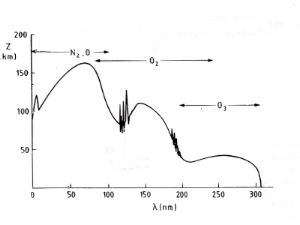
5. Spettro di assorbimento: l'immagine mostra gli spettri di assorbimento combinati dei principali responsabili dell’assorbimento della radiazione solare nell'alta atmosfera. La radiazione con lunghezze d'onda inferiori a 200 nm è assorbita già nella ionosfera e nella mesosfera grazie alla presenza di azoto molecolare N2, di atomi di O e di ossigeno molecolare O2. La radiazione tra 200 e 320 nm arriva più in basso, nella stratosfera, (sotto i 50 km), dove è assorbita dall'ozono O3. Infine, la radiazione con lunghezze d'onda superiori a 320 nm, raggiunge la superficie terrestre.
Cliccare per allargare!
|
|
|
Una piccola frazione di radiazione UV-B riesce comunque a raggiungere la superficie terrestre. La presenza di questa radiazione ad alta energia permette la formazione del radicale ossidrile (OH), il quale è in grado ripulire l'atmosfera da composti chimici dannosi. Questa radiazione, tuttavia, danneggia il DNA ed è responsabile delle scottature solari.
|
La deplezione dell'ozono da parte dei radicali
Le concentrazioni di ozono che si misurano non possono essere semplicemente spiegate dalle reazioni di Chapman. La ricerca scientifica condotta a partire dal 1970 ha dimostrato che anche gli ossidi di azoto e i radicali di alogeni reattivi sono coinvolti nella chimica dell'ozono. Gli scienziati, Paul Crutzen, Mario Molina e F. Sherwood Rowland, hanno vinto il Premio Nobel per la Chimica nel 1995 per il loro lavoro che ha dimostrato come i clorofluorcarburi siano in grado di distruggere l'ozono.
|
 |
 |
 |
|
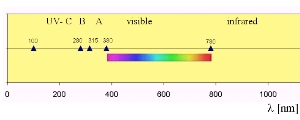
6. Radiazione UV nella spettro elettromagnetico
Esistono diversi modi per definire le varie regioni dello spettro UV. In quella qui riportata la radiazione UV-A va a 315 a 380 nm. L’ IPCC invece definisce UV-A la radiazione con lunghezze d'onda tra 315 e 400 nm. composto da: Elmar Uherek. Cliccare per allargare! (60 K)
|
|
 |
 |
|
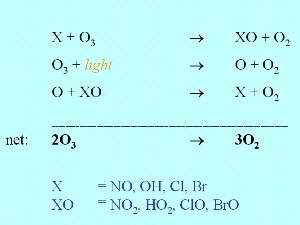
7. La deplezione chimica dell'ozono X rappresenta un composto come NO, OH, Cl o Br che reagisce con l'ozono. Cliccare per allargare! (40 K)
|
|
 |
L'ozono non è rimosso solamente dalla radiazione ultra-violetta proveniente dal sole ma anche dalla reazione con i composti reattivi come l'ossido nitroso (NO), il radicale ossidrile OH o i radicali di alogeni come Cl e Br.
I tre scienziati avevano previsto una leggera diminuzione nelle concentrazioni di ozono dal momento in cui le attività umane avrebbero iniziato a rilasciare nell'atmosfera quantità significative di specie contenenti alogeni. Tuttavia, nessuno aveva previsto che si sarebbe verificata una diminuzione così drammatica dei livelli di ozono nella stratosfera sopra l'Antartide. |
A proposito di questa pagina:
autore: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz, Germany
revisione scientifica: Dr Christoph Bruhl - Max Planck Institute for Chemistry, Mainz
revisione didattica: Michael Seesing - Uni Duisburg - 2003-08-07
ultima pubblicazione: 2004-05-11
|
|
 |
|







