|
|
 |
|
|
|
 |
| |
|
|
 |
Bassa Atmosfera
Principi |
Ossidi di azoto
Gli ossidi di azoto hanno un ruolo importante nella chimica della nostra atmosfera. In questa sezione osserviamo come si formano e perché sono così importanti.
|
1. Traffico, un'importante fonte di ossidi di azoto. (c) FreeFoto.com |
|
|
|
|
 |
Da dove derivano gli ossidi di azoto?
Le forme più importanti di azoto reattivo nell'aria sono il monossido di azoto (NO) e il biossido di azoto (NO2). Insieme sono chiamati NOx. Gli ossidi di azoto si formano nell'atmosfera principalmente dalla dissociazione del gas azoto (N2). Siccome i due atomi di azoto in N2 sono legati da un legame molto forte (il triplo legame azoto-azoto), non è facile spezzare N2 in due. Alcuni batteri hanno sviluppato speciali meccanismi per farlo. Ma anche le temperature molto elevate possono rompere questo legame. I motori dei veicoli raggiungono temperature sufficientemente alte da emettere ossidi di azoto nei gas di scappamento. I convertitori catalitici montati sulle automobili diminuiscono la produzione di questi composti dannosi. Gli ossidi di azoto si possono anche formare quando viene bruciata la biomassa e durante i temporali.
2. destra: il fulmine è un'altra importante fonte di ossidi di azoto. Immagine di Bernhard Mühr / Karlsruher Wolkenatlas.
|
 |
|
 |
 |
|
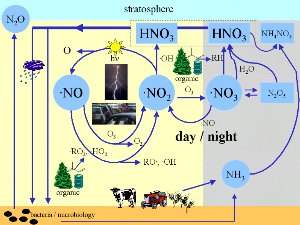
3. Questa figura offre una visione d'insieme del ruolo degli ossidi di azoto in alcuni dei più importanti processi nella chimica dell'atmosfera. Cliccare per allargare (100 K). di Elmar Uherek.
|
|
 |
In che cosa sono coinvolti?
NOx (= NO + NO2) e altri ossidi di azoto sono importanti in quasi tutte le reazioni atmosferiche. Un'altra forma di ossido di azoto, è il radicale nitrato molto reattivo (NO3) che si forma al buio e controlla la chimica dell'atmosfera notturna. Gli ossidi di azoto reagiscono con l'acqua per formare l'acido nitrico (HNO3). L'acido nitrico non contribuisce solo alla formazione delle piogge acide ma è anche il mezzo principale attraverso cui gli ossidi di azoto sono rimossi dall'aria, sia per deposizione secca dell'acido o per la rimozione nelle piogge. L'acido nitrico è anche importante nella chimica delle nuvole stratosferiche polari. Qui si presenta come acido nitrico triidrato e questa specie contribuisce alla formazione del buco dell'ozono.
|
|
Names of nitrogen compounds: - Nomi dei composti dell'azoto:
|
Formula |
Nome Sistematico |
Nome Comune |
|
NO |
ossido di azoto |
monossido di azoto |
|
N2O |
ossido di diazoto |
protossido di diazoto |
|
NO2 |
diossido di azoto |
biossido di azoto |
|
N2O5 |
pentossido di diazoto |
pentossido di azoto |
|
N2O3 |
triossido di diazoto |
triossido di azoto |
|
HNO3 |
acido di ossoazoto (V) |
acido nitrico |
|
NH3 |
- |
ammoniaca |
|
|
Gli ossidi di azoto sono molto importanti nella formazione e nella distruzione dell'ozono troposferico. Sono coinvolti nei cicli catalitici dove reagiscono e si riformano continuamente. Il biossido di azoto (NO2) è degradato dalla luce solare per formare monossido di azoto (NO). Questo reagisce per formare nuovamente NO2. Anche l'ozono e composti di ossigeno reattivi conosciuti come radicali perossidici possono essere coinvolti in questo ciclo. Analizzeremo queste reazioni in maggior dettaglio in seguito. Durante i processi di combustione, soprattutto quelli che avvengono nei motori dei veicoli, si emettono troppi ossidi di azoto Lo scopo principale dell'uso di convertitori catalitici nelle automobili è quello di ridurre le di questi composti. Altri importanti gas contenenti azoto presenti nell'atmosfera sono: Il protossido di azoto (N2O) che si forma durante i processi di degradazione microbica. E' un importante gas serra ma non reagisce nella troposfera. Nella stratosfera distrugge l'ozono. L'ammoniaca (NH3) è il gas più importante a carattere basico presente nell'atmosfera. Deriva principalmente dall'agricoltura, sia dallo stoccaggio di rifiuti animali che dall'uso di fertilizzanti. Reagisce nell'atmosfera con specie acide, come l'acido nitrico, per formare particelle di aerosol.
|
Ossidi di azoto - al centro della chimica dell'atmosfera
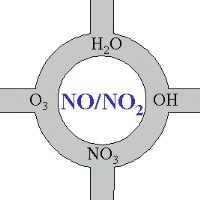
Gli ossidi di azoto sono veramente al centro della chimica dell'atmosfera. Molti dei composti chimici che sono ossidati e rimossi dall'aria o trasformati in altre specie chimiche entrano in contatto direttamente o indirettamente con NO o NO2.
|
 |
 |
 |
|
4. Ossidi di azoto - al centro della chimica dell'atmosfera. Immagine Elmar Uherek.
|
|
|
Pagine collegate
I radicali nitrato hanno un ruolo speciale nella chimica notturna. Scopri di più in:
Bassa Atmosfera - Approfondimento - Unità 1 - Notte e nitrato
Ulteriori informazioni sul collegamento tra gli ossidi di azoto e il buco dell'ozono sono disponibili in:
Alta Atmosfera - Approfondimento - Unità 2 - Chimica del cloro
Impariamo di più sul ciclo dell'azoto e la sua relazione con l'ozono in
ACCENT Global Change Magazine - Edizione No 8 Aprile 2006
A proposito di questa pagina:
Versione italiana: Laura Dini (traduttore) e Michela Maione (revisione linguistica)
autore: Dr. Elmar Uherek - Max Planck Institute for Chemstry, Mainz, Germany
revisione scientifica: Dr. Rolf von Kuhlmann - Max Planck Institute for Chemistry, Mainz, Germany
revisione didattica: Michael Seesing - Uni Duisburg, Germany - 2003-07-02
ultima pubblicazione: 2004-04-30
|
|
 |
|







