|
|
 |
|
|
|
 |
| |
|
|
 |
Bassa Atmosfera
Principi |
Ozono Troposferico
L'ozono è probabilmente il più famoso gas nella scienza del clima. Perché?
L'ozono è un gas pieno di contraddizioni. E' essenziale nella stratosfera,dove ci protegge dai danni della radiazione ultravioletta proveniente dal Sole, ma è dannoso nella troposfera quando raggiunge concentrazioni elevate in quanto causa problemi alla salute. In alcune grandi città, per prevenire il verificarsi di fenomeni di inquinamento da ozono il traffico può essere bloccato per alcuni giorni.
|
|
|
|
|
 |
|
Oltre a causare problemi alla salute, l'ozono troposferico è un forte gas serra e contribuisce al riscaldamento globale.
In questa unità analizziamo come l'ozono troposferico sia dannoso per le piante e gli uomini e in che modo agisce da gas serra. Nella sezione sull'Alta Atmosfera, vedremo come l'ozono stratosferico ci protegge dalla radiazione ultravioletta dannosa.
|
1. a-e) Il danneggiamento cronico della pianta è uno degli impatti negativi dell'ozono. Queste fotografie mostrano foglie di prunus serotina (la ciliegia autunnale) danneggiate al 0%, 4.4%, 7.8%, 12.3% e 24.5%. Fonte: Innes, Skelly, Schaub - Ozon, Laubholz- und Krautpflanzen, ISBN 3-258-06384-2, Copyright by Haupt Verlag AG / Switzerland.
Cliccare per allargare le immagini! (about 25 KB)
|
L'ozono è un gas che possiede molte proprietà. Alcune sono utili altre no. L'ozono lo troviamo nei diversi strati dell'atmosfera.
Lo strato di ozono stratosferico si crea ad altitudini superiori a 10 km. Questo ozono è essenziale poiché impedisce alla radiazione ultravioletta dannosa proveniente dal sole di raggiungere la terra e previene il verificarsi di tumori della pelle.
Piccole quantità di ozono nella troposfera sono necessarie in quanto aiutano a ripulire l'aria da elementi chimici dannosi. Tuttavia negli ultimi decenni, i livelli di ozono sono aumentati continuamente. Durante gli episodi di inquinamento da ozono, i livelli possono essere così alti da essere pericolosi per la nostra salute.
|
 |
 |
 |
|
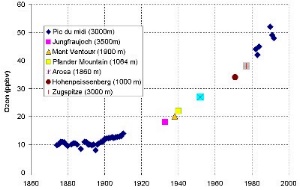
2. I livelli di ozono troposferico sono aumentati continuamente dalle prime misurazioni effettuate nel 1870. Il diagramma mostra la frazione di ozono in ogni miliardo di frazione di volume di aria = ppbv. Creato da Valérie Gros, MPI Mainz, adattato da: Marenco et al., 1992 (Long term evolution of ozone at the mid-latitudes of the Northern Hemisphere, European Geophysical Society, XVII General Assembly, 6-10 April 1992, Edinburgh).
Cliccare per allargare!
|
|
|
|
 |
Danni al sistema respiratorio
L'ozono è un gas reattivo e irritante e, ad alte concentrazioni, porta a problemi respiratori. Causa infiammazioni a polmoni e bronchi. Il nostro organismo fa del suo meglio per proteggere i polmoni dall'ozono. Tuttavia, per impedire all'ozono di entrare nei polmoni si riduce anche la quantità di ossigeno che possiamo assorbire e questo fa lavorare di più il cuore. Le persone con problemi respiratori come l'asma sono particolarmente a rischio. Nei casi peggiori, alti livelli di ozono possono causare la morte.
|
Ozono - una forma speciale di ossigeno
L'ozono è una forma speciale di ossigeno. Le normali molecole di ossigeno (O2) sono formate da due atomi di ossigeno mentre l'ozono è formato da tre (O3). E' meno stabile, più reattivo ed è capace di distruggere materiale organico. Per questo danneggia le piante e causa problemi alla salute umana. Osserviamo in maggior dettaglio cosa succede nella sezione di "approfondimento" di questa Unità.
|
 |
 |
 |
|
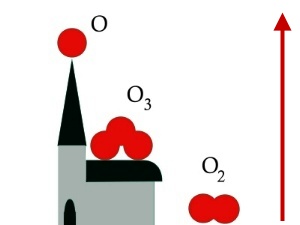
3. Le tre forme dell'ossigeno caratterizzate da diverse. La freccia mostra come aumenta la reattività.
Immagine di Elmar Uherek.
|
|
|
Forme di ossigeno nell'aria
|
forma di ossigeno |
numero di atomi |
stabilità chimica |
presenza nell'aria |
|
ossigeno atomico |
1 atomo |
instabile / molto reattivo |
ultra tracce |
|
ossigeno 'normale' |
2 atomi |
stabile |
21% dell'aria |
|
ozono |
3 atomi |
moderatamente stabile / reattivo |
10 - 100 ppb | |
ppb = parti per miliardo
|
L'ozono come gas serra
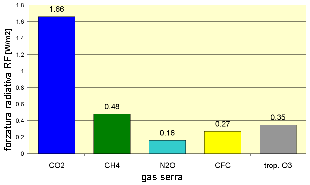
Dopo l'anidride carbonica (CO2) e il metano (CH4), l'ozono troposferico è il terzo più importante gas serra, capace di assorbire la radiazione termica proveniente dalla superficie terrestre e di intrappolare questo calore nella troposfera. La forzatura radiativa addizionale ( F) a partire dalla Rivoluzione Industriale (intorno al 1750) ci dà una misura del contributo delle attività dell'uomo al riscaldamento della Terra. Il grafico mostra l'impatto dell'ozono troposferico (colonna grigia) paragonato a quello di altri gas serra.
L'ozono troposferico causa problemi alla salute, danneggia le piante e agisce come forte gas serra contribuendo al riscaldamento globale. Perciò abbiamo bisogno di trovare dei modi per ridurre le concentrazioni di ozono nella troposfera.
|
 |
 |
 |
|
4. Il contributo di diversi gas serra alla forza radiativa ( F). (Dati IPCC AR 4 2007). Quanto contribuiscono al riscaldamento globale?
|
|
Calcola quanto ogni gas serra contribuisce al riscaldamento globale!
Il grafico sopra mostra il contributo di diversi gas serra alla forzatura radiativa positiva in troposfera (calcolata in W m-2). L'equazione di seguito mostra come la temperatura media sulla superfice terrestre ( TS) cambia in risposta ai cambiamenti nella forzatura radiativa.
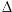 TS / TS / 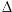 F = 0.5 °C / W m-2 F = 0.5 °C / W m-2
Sei in grado di calcolare il cambiamento di temperatura ( TS) causato dall'anidride carbonica, dal metano, dall'ozono e dal ossido di azoto?
|
|
Pagine Collegate
Ulteriori informazioni sull'ozono troposferico in:
Bassa Atmosfera - Approfondimento - Unità 3
L'ozono stratosferico e la deplezione dello strato di ozono sono discussi in dettaglio in:
Alta Atmosfera - Principi - Unità 2
Alta Atmosfera - Approfondimenti - Unità 2
Valori di fondo dell'ozono troposferico e misure sono discussi nel
ACCENT Global Change Magazine - Edizione No 8 Aprile 2006
A proposito di questa pagina
Versione italiana: Laura Dini (traduttore) e Michela Maione (revisione linguistica)
autore: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz, Germany
revisione didattica: Michael Seesing - Uni Duisburg, Germany - 2003-07-02
revisione scientifica: Dr. Rolf von Kuhlmann, Max Planck Institute for Chemistry, Mainz, Germany
ultima pubblicazione: 2008-06-23
|
|
 |
|







