|
|
 |
|
|
|
 |
| |
|
|
 |
Bassa Atmosfera
Approfondimento |
Condizioni e chimica notturna
La chimica dell'atmosfera dipende non solo dai composti chimici presenti nell'aria ma anche dalle condizioni fisiche. Queste condizioni fisiche dipendono, per esempio, dalla stagione, dal giorno o dalla notte, dalla temperatura e da quanto è umida l'aria.
|
|
|
|
|
 |
 |
 |
|
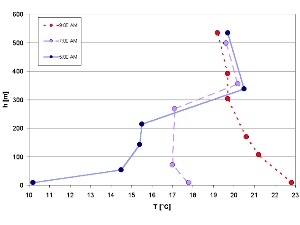
1. Inversione della temperatura che scende drasticamente al mattino a Luglio (Isar Valley / Germania). Di Elamr Uherek e adattato da: Schirmer - Wetter und Klima - Wie funktioniert das? Cliccare per allargare (50 K).
|
|
 |
Il ciclo diurno
Nell'ultima sezione abbiamo visto che le concentrazioni di OH sono le più alte durante il giorno e si avvicinano allo zero di notte quando non c'è la luce solare. Anche la temperatura e altre proprietà fisiche mostrano un ciclo diurno o giornaliero.
Le condizioni vicine al suolo nello strato limite variano e non seguono sempre una regola generale (ad es. la temperatura diminuisce all'aumentare dell'altitudine) a causa delle interazioni con la superficie terrestre. Un esempio veramente tipico è lo strato di inversione notturno che scende drasticamente al mattino. |
Inversione notturna nello strato limite planetario
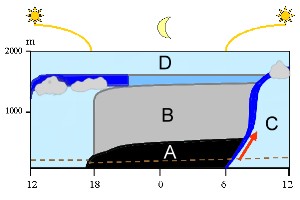
Tutto quello che si trova sotto l'atmosfera libera (D) fa parte dello strato limite planetario. I cambiamenti all'interno di questo strato che si verificano durante il giorno sono mostrati nel diagramma con orario crescente da sinistra a destra . A mezzogiorno l'aria è ben mescolata (blu chiaro). Dopo il tramonto si forma uno strato notturno stabile (A) sopra il quale rimane dell'aria residua (B). L'aria dello strato superficiale (sotto la linea marrone tratteggiata) non riesce a salire ad elevate altitudini durante la notte perché non c'è l'energia solare a guidare questo movimento. Il terreno si riscalda, l'aria inizia a salire (freccia rossa) e gli strati stabili che si formano durante la notte vengono meno. Una zona chiamata "zona di intrappolamento" sale dal terreno fino alla cima allo strato limite (blu scuro) e provoca il rimescolamento dell'aria (C).
|
 |
 |
 |
|
2. Modello dello strato di confine planetario. Lo spessore dello strato di confine planetario può variare (vedere le diverse altitudini alle 12:00 in punto)
Di Elmar Uherek, adattato da Stull, 1988. Cliccare per allargare (70 K).
|
|
In inverno l'energia solare non è sempre abbastanza forte da rompere lo strato di inversione al mattino e lo strato persiste per l'intera giornata o persino per diversi giorni. In questa situazione, l'inquinamento si accumula sopra le città e porta alla formazione di smog. In maniera simile, nelle valli e tra le montagne lo strato di inversione può essere intrappolato sotto lo strato di nuvole.
|
 |
 |
 |
|
3. Strato di inversione durante l’ inverno in montagna. © Institute for Geographical Education, University of Erlangen-Nurnberg, Germany.
|
|
 |
 |
|
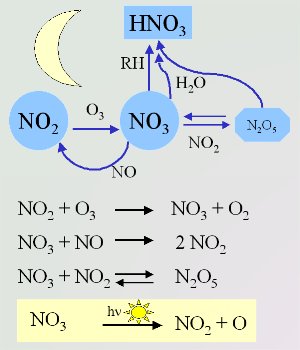
4. Importanti reazioni notturne del radicale nitrato. Il radicale è degradato dalla luce solare al sorgere del sole (mostrato nel riquadro giallo). Schema di Elmar Uherek.
Cliccare per allargare!
|
|
 |
Chimica del radicale nitrato
La chimica dell'atmosfera notturna è dominata dal radicale nitrato (NO3). Questi radicali si formano dalla reazione dell'ozono (O3) con il biossido di azoto (NO2). La reazione di NO3 con NO2 è il solo modo per formare il pentossido di diazoto (N2O5) atmosferico. Questo (N2O5) funziona come un serbatoio di NO3. Può scomporsi per dare nuovamente NO3 e NO2 o reagire con l'acqua per formare acido nitrico (HNO3)
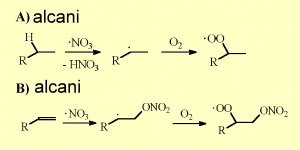
NO3 reagisce con le molecole organiche allo stesso modo dell'OH. Rimuove un atomo di idrogeno dagli alcani per formare un radicale alchilico organico (R) che a sua volta reagisce con O2 nell'aria per formare radicali perossidici (RO2).
|
NO3 può anche reagire con i doppi legami dei composti organici non saturi per formare i perossinitrati per aggiunta di O2. L'emivita di NO3 / N2O5 diminuisce drasticamente all'aumentare delle concentrazioni di vapore acqueo. Quanto più aumentano i livelli di vapore acqueo, tanto più NO3 è trasformato in acido nitrico (HNO3), in particolare nelle pellicole liquide sulle superfici.
Tutte le specie perossidiche derivano da radicali OH e NO3 oppure dalle reazioni con ozono. Nell'atmosfera avvengono numerose ulteriori reazioni piuttosto complicate che portano, ad esempio, alla formazione di alcooli, aldeidi, nitrati e acidi carbossilici.
|
 |
 |
 |
|
5. Reazioni di radicale di azoto con alcani e alcheni. Cliccare per allargare (30 K).
|
|
 |
 |
|
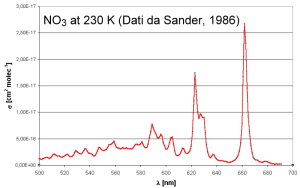
6. Spettro di assorbimento nel visibile del radicale nitrato. L'assorbimento massimo si verifica nella parte rossa dello spettro (600-700 nm). Le misurazione sono state realizzate a 230 K. Adattato da Sander (1986).
|
|
 |
I radicali NO3 assorbono la luce nella parte rossa dello spettro visibile. Non appena sorge il sole, il radicale nitrato si fotolizza principalmente per dare principalmente NO2 e O atomico e le concentrazioni di NO3 scendono a zero. A questo punto inizia la produzione di radicale ossidrile (OH) che diventa il più importante ossidante presente nell'atmosfera.
L'ozono, il terzo più importante ossidante nell'atmosfera, non reagisce con gli alcani ma può reagire con gli alcheni (gli idrocarburi insaturi con un doppio legame carbonio-carbonio). Ciò avviene soprattutto in inverno e di sera quando le concentrazioni di OH sono basse. In questa unità analizzeremo anche la chimica atmosferica dell'ozono.
|
|
Pagine collegate
Scopri qualcosa di più sugli ossidi di azoto nell'aria in:
Bassa Atmosfera - Principi - Unità 3 - Ossidi di azoto
A proposito di questa pagina:
Versione italiana: Laura Dini (traduttore) e Michela Maione (revisione linguistica)
autore: Dr. Elmar Uherek - Max Planck Institute for Chemistry, Mainz, Germany
revisione scientifica: Dr. Mark Lawrence - Max Planck Institute for Chemistry, Mainz - 2004-05-05
revisione didattica: Michael Seesing - Uni Duisburg - 2003-07-02
ultima pubblicazione: 2004-05-07
|
|
 |
|







