|
|
 |
|
|
|
 |
| |
|
|
 |
Climat urbain
Bases |
Qu'est-ce que la pluie acide ?
L'eau est indispensable à la vie sur Terre. Lorsqu'elle est polluée, c'est tout l'environnement qui est touché. La pluie acide est la conséquence de la pollution de l'air d'origine humaine, à cause de la combustion des énergies fossiles. L'acidité de la pluie est mesurée avec une échelle pH.
|
|
|
|
|
 |
|
Les précipitations (la pluie, la grêle, la neige, etc...) alimentent les rivières et les lacs, s'infiltrent dans le sol, ou s'évaporent et se transforment en vapeur d'eau. Pour décrire la qualité d'une eau, le pH est un paramètre important.
|
 |
 |
|
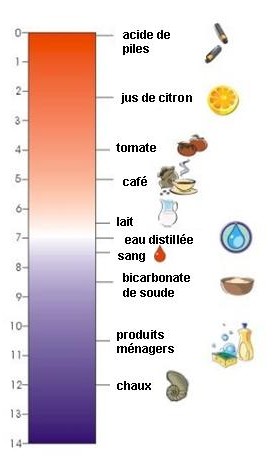
1. L'échelle pH. Plus le chiffre est bas et plus c'est acide.
Auteur: Sebastian Wypych
|
|
 |
L'échelle pH
Chaque liquide a un pH donné. Plus il est acide, plus son pH est bas.
Le pH est l'opposé du logarithme de la concentration en ion hydronium H3O+ (en moles par litre, mol/l). Si la concentration des ions hydronium vaut (H3O+) = 10-7mol/l, le pH est alors de 7, si elle vaut 10-6 mol/l, le pH est de 6 etc...
pH = -log10[H3O+]
Cette échelle a été inventée par le scientifique danois Soren Sorenson en 1909. Elle va de 0 à 14, avec la valeur 7 qui est considérée comme neutre. Lorsque le pH est supérieur à 7 on dit qu'il est basique, lorsqu'il est inférieur à 7 on dit qu'il est acide. Par exemple, le vinaigre est acide, il a un pH de 2,5; l'eau distillée a un pH de 7, le bicarbonate de soude a un pH de 8,5 et la chaux de 12. La construction de cette échelle est basée sur le fait que l'eau pure se dissocie en ions hydronium H3O+ et en ions hydroxydes OH-

Pour cette dissociation on peut appliquer la loi d'action de masse. La constante Kw est appelée produit ionique de l'eau, et sa valeur est toujours de 10-14.
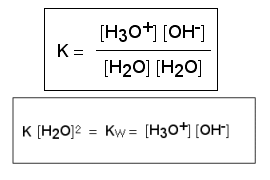
|
|
Ainsi la loi pour tout acide ou base donne pKw = pH + pOH = 14
Dasns l'eau pure c(H3O+) = c(OH-) = 10-7 mol/l et pKw = 7 + 7 = 14
On appelle cela l'auto-dissociation de l'eau.
Pluie acide
Les précipitations sont naturellement acides, car le dioxyde de carbone (CO2) qui se trouve dans l'air se dissout dans les gouttes d'eau, devient de l'acide carbonique (H2CO3) ce qui abaisse le pH aux environs de 5,6. Ceci car l'acide carbonique n'est pas stable et se dissocie dans l'eau pour former des ions hydronium et l'ion hydrogénocarbonate : |
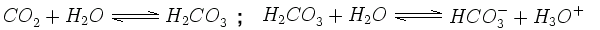 |
 |
|
Dans une solution plus basique (dite aussi plus alcaline) où le pH est plus élevé, l'ion hydrogénocarbonate peut perdre un autre ion hydrogène pour devenir du carbonate. Beaucoup de pierres, de montagnes et de sédiments sont constitués de sels de carbonate, comme la chaux ou la dolomite.
|
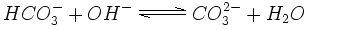 |
 |
|
|
|
L'eau de pluie même non polluée est légèrement acide à cause de la dissociation de l'acide carbonique. On parle de pluie acide lorsque le pH de la précipitation est inférieur à 5,6. Certains scientifiques considèrent néanmoins que la pluie est acide lorsque son pH est inférieur à 5,0. En plus de la pluie, il existe de la neige ou du brouillard acides, donc on peut parler de précipitation acide. Les Hommes sont responsables de ces pluies acides de part les émissions de composés azotés et soufrés. SO2 and NOx sont impliqués dans de multiples processus chimiques avant de former de l'acide sulfurique (H2SO4) ou de l'acide nitrique (HNO3) qui causent les pluies acides.
|
 |
L'acide sulfurique provient de composés soufrés:
SO2 +O2 ->-> SO3
SO3 + H2O -> H2SO4
L'acide nitrique vient des oxydes d'azote :
NOx + H2O -> -> HNO3 |
|
Le pH d'un nuage acide peut descendre jusqu'à 2,6 ! Le pH dans les zones très industrialisées est généralement d'environ 4,0. Les brouillards de Los Angeles ont souvent un pH inférieur à 3,0. Cependant il peut arriver, à certains endroits dans le monde, que les émissions de composés chimiques par la végétation naturelle fasse baisser le pH jusqu'à des valeurs de 4,4.
|
En cause: les émissions de SO2 et de NOx
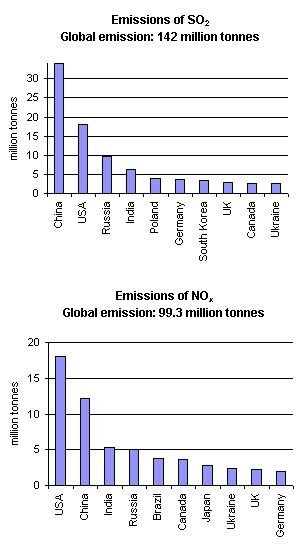
Qu'est-ce qui cause la pluie acide? Des acides se forment dans l'atmosphère après les réactions chimiques de l'eau avec des gaz précurseurs (SO2 et NOx). La principale source de SO2 et de NOx est due à la combustion des énergies fossiles. Le transport routier, maritime et aérien est une source significative de NOx; des sources naturelles existent, comme les volcans, les éclairs orageux et la dégradation des organismes vivants. Les sources naturelles de SO2 sont les volcans, les océans, la dégradation des organismes vivants et les feux de forêts. Les pluies acides sont cependant avant tout la conséquence des émissions humaines. La Figure 2 montre quels sont les 10 pays du monde qui émettent le plus de SO2 et de NO2. Dans les deux cas, ce sont les USA, la Chine, la Russie et l'Inde qui émettent les plus grosses quantités, en partie à cause de leur population élevée.
|
 |
 |
 |
|
2. Les émissions de SO2 et de NOx en 1995
Auteur: Anita Bokwa
Source des données: World Resources Institute, Washington DC
http://earthtrends.wri.org
|
|
On ne connait pas bien les émissions totales
Il existe des incertitudes considérables sur les quantités totales de SO2 et de NOx émises. On suppose que les émissions naturelles représentent 25 à 50% des émissions totales de SO2. Cependant dans les régions industrialisées et urbanisées, les émissions causées par les humains peuvent atteindre 90% du SO2 et des NOx. Les incertitudes varient d'une région à l'autre: on ne connaît pas toujours bien les quantité émises, en particulier dans le secteur de l'agriculture, ni ce que les sols et les systèmes aquatiques émettent précisément.
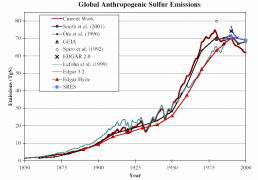
La Figure 3 présente les résultats de plusieurs études. Attention, sur les figures 3 et 4, les valeurs sont indiquées en soufre pur, tandis que sur la figure 2 il s’agit de dioxyde de soufre.
|
 |
 |
 |
|
3. Augmentation des émissions de soufre anthropiques mondiales. Ce diagramme rassemble plusieurs etudes présentées ensemble.
Source: S. J. Smith, R. Andres, E. Conception, J. Lurz, 2004, Sulfur dioxide emissions: 1850-2000 (JGCRI Report. PNNL-14537)
Cliquez sur l’image pour l’agrandir (26 K)!
|
|
|
Les émissions varient
A cause des humains le taux de fixation de l'azote (N) a doublé par rapport à sa valeur naturelle, et les taux de dépôt de l'azote atmosphérique ont été multipliés de 3 à 10 par rapport à la période pré-industrielle. Les émissions de soufre (S) ont quant à elles plus que doublé.
|
 |
 |
|
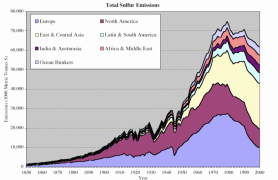
4. Contribution des principales zones économiques mondiales aux emissions anthropiques de soufre depuis 1850.Source: S. J. Smith, R. Andres, E. Conception, J. Lurz, 2004, Sulfur dioxide emissions: 1850-2000 (JGCRI Report. PNNL-14537) Explications: Austurasia = Australie, Nouvelle Zélande, Asie du sud est; Ocean Bunkers = utilisation de combustibles fossiles pour la pêche maritime
Cliquez sur l’image pour l’agrandir (66 K)!
|
|
 |
Les émissions de soufre en Europe ont énormément augmenté à la fin du 19ème siècle, à cause de l'industrialisation et de la combustion du charbon. Après 1945 c'est surtout la consommation de pétrole qui a pris le pas; les émissions de soufre ont doublé entre la fin de la guerre en 1945 et le début des années 70.
De nos jours c'est surtout en Asie que se pose le problème des pluies acides; on s'attend à ce que les émissions de SO2 triplent entre 1990 et 2010 si rien ne change.
|
|
Pour réparer les dégâts déjà causés par les pluies acides en Asie et éviter que la situation n'empire dans le futur, il faudra faire des investissements pour limiter la pollution, comme ceux que l'Europe et l'Amérique du Nord ont engagé depuis une vingtaine d'années. Par exemple, les émissions de soufre en Europe ont été réduites de 44% entre 1990 et 1998. Aux USA et au Canada, les émissions de SO2 ont chuté de 28% entre 1980 et 1995.
Les émissions sont concentrées dans certaines parties du globe. C'est l'Asie du sud-est qui émet le plus de SO2, tandis que les USA sont les plus gros émetteurs de NOx.
|
A propos de cette page:
Auteur: Anita Bokwa - Jagiellonian University - Cracow / Poland
dernière version: 2004-06-16
|
|
 |
|







