|
|
 |
|
|
|
 |
| |
|
|
 |
Basse atmosphère
Plus |
La chimie atmosphérique pendant la nuit
Toutes les réactions chimiques qui ont lieu dans l'atmosphère ne dépendent pas uniquement des composés émis, mais aussi des conditions existantes: elles sont fonction de la saison, du moment de la journée, de la température, de l'humidité...
|
|
|
|
|
 |
 |
 |
|
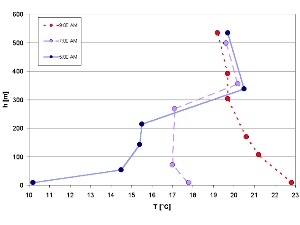
1. Inversion de température avant le lever du soleil, puis disparaissant dans la matinée (mesures en juillet dans la vallée de l'Isar, en Allemagne).
par Elmar Uherek d'après: Schirmer - Wetter und Klima - Wie funktioniert das?
Cliquez pour agrandir (50 K)!
|
|
 |
Le cycle journalier
Dans la partie précédente ('Réactions dans l'atmosphère') nous avons abordé le cylce diurne de OH, dont la formation dépend du soleil. Mais les composés chimiques ne sont bien sûr pas les seuls à varier en fonction du jour et de la nuit, puisque les conditions atmosphériques évoluent aussi, comme la température par exemple. Les conditions de température près du sol sont particulières et ne suivent pas toujours les tendances générales, à cause de l'influence de la surface de la Terre sur cette partie de l'atmosphère (appelée couche limite planétaire). Par exemple, alors que d'une façon générale la température baisse avec l'altitude dans la troposphère (il fait plus froid en montagne), il arrive qu'on observe une "inversion de température" pendant la nuit, qui disparaît avec le lever du soleil. Regardez le graphe ci-contre, vous verrez qu'à 5 heures du matin la température augmentait avec l'altitude, et que cela a changé ensuite, à 7 heures puis à 9 heures du matin, où l'évolution de la température avec la hauteur est redevenue "normale". |
Inversion nocturne de température dans la couche limite planétaire
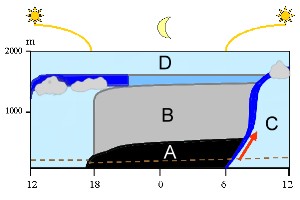
L'air qui se trouve sous la partie D de la troposphère est dans la couche limite planétaire. Pendant la journée, beaucoup de choses changent (de gauche à droite): à midi, l'air est bien mélangé (en bleu clair). Après le coucher du soleil, il se forme la nuit une couche d'air stable (A) avec une autre couche au dessus (B). L'air qui se trouve très près du sol (sous la ligne pointillée) ne peut pas s'élever pendant la nuit, car il n'a pas assez d'énergie pour le faire. Cette énergie revient avec le lever du soleil. Le sol se réchauffe, l'air réchauffé s'élève (flèche rouge) et la couche qui était stable durant la nuit se disperse. L'air s'élève du sol vers le haut de la couche limite planétaire (c'est ce qu'on appelle une zone d'entraînement, en bleu foncé) et permet à toutes ces couches d'air de se mélanger de nouveau pour la journée (C).
|
 |
 |
 |
|
2. La couche limite planétaire. L'épaisseur de cette couche est variable.
par Elmar Uherek, d'après Stull 1988
Cliquez pour agrandir ! (70 K)
|
|
Parfois, en hiver, il paut arriver que le soleil ne soit pas assez fort pour dissoudre cette couche d'inversion, qui reste toute la journée ou même plusieurs jours. Dans de tels cas, la pollution s'accumule parce que l'air ne se mélange pas. Il peut y avoir du smog dans les villes. Les vallées présentent souvent des conditions particulières, comme on peut le voir sur la photo de droite. L'inversion de température existe sous une épaisse couche de nuages.
|
 |
 |
 |
|
3. Couche d'inversion en hiver dans les montagnes
© Inst. for geographical education, Univ. of Erlangen-Nürnberg
|
|
 |
 |
|
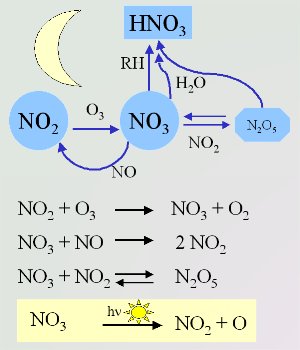
4. Les réactions du nitrate les plus importantes pendant la nuit (en jaune, la réaction pendant la journée)
Schéma par Elmar Uherek
|
|
 |
Le nitrate et la chimie atmosphérique
Les réactions chimiques qui se passent dans l'air ne sont pas les mêmes pendant la nuit. C'est le nitrate qui prend la place de OH (très actif le jour) pour réagir avec les espèces chimiques organiques. Le radical nitrate NO3 se forme par réaction de l'ozone O3 avec le dioxyde d'azote NO2 . La réaction de NO3 et NO2 est la seule source de N2O5 dans l'atmosphère. Ce composé peut se décomposer pour redonner du NO2 et du NO3 .
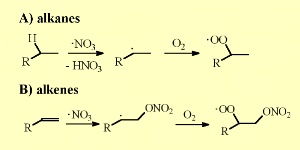
Le radical nitrate agit de la même façon que OH: il arrache un hydrogène aux alcanes par exemple. |
Lorsque la quantité de vapeur d'eau dans l'air augmente, la durée de vie de NO3 et de N2O5 diminue fortement. En effet, ils réagissent avec l'eau pour donner de l'acide nitrique HNO3 , surtout d'ailleurs sur les surfaces recouvertes d'un film d'eau liquide.
Toutes les espèces formées par les réactions avec OH, NO3 ou l'ozone réagissent ensuite avec d'autres composés dans l'atmosphère pour donner une multitude de produits différents, dont nous ne parlerons pas ici.
|
 |
 |
 |
|
5. Les réactions du nitrate avec les alcanes et les alcènes
Cliquez pour agrandir (30 K)!
|
|
 |
 |
|
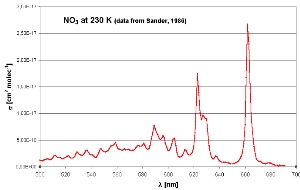
6. Le spectre d'absorption du nitrate dans le domaine visible avec un maximum dans la partie rouge du spectre (600-700 nm)
d'après Sander (1986). Les mesures ont été faites à 230 Kelvin, soit -43°C.
|
|
 |
Comme beaucoup de composés atmosphériques, le NO3 absorbe en partie la lumière visible, qui s'étend sur des longueurs d'ondes allant de 400 à 700 nm. Il absorbe principalement dans le rouge (vers la fin du spectre, de 620 à 700 nm). Dès que le jour se lève, le NO3 se casse pour donner NO2 et O et c'est alors OH qui reprend son rôle. L'ozone, qui est le troisième oxydant important de l'atmosphère, n'est pas aussi réactif que OH mais peut parfois entrer en compétition avec lui (pour réagir avec les alcènes par exemple) lorsque l'ensoleillement est faible (en hiver ou le soir).
|
A propos de cette page:
auteur: Dr. Elmar Uherek - MPI for Chemistry Mainz
relecteur scientifique: Dr. Mark Lawrence, MPI for Chemistry, Mainz, 2004-05-05
relecteur pédagogique: Michael Seesing - Uni Duisburg - 2003-07-02
dernière version: 2004-05-07 |
|
 |
|







