|
|
 |
|
|
|
 |
| |
|
|
 |
Basse atmosphère
Plus |
Exercices 2: Les relations entre la lumière, l'absorption et la couleur
|
|
|
|
|
 |
 |
 |
|
Figure 1: spectre de la lumière blanche
© 2004 Seesing, Tausch; Universität Duisburg-Essen, Duisburg [Lit:Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993]
|
|
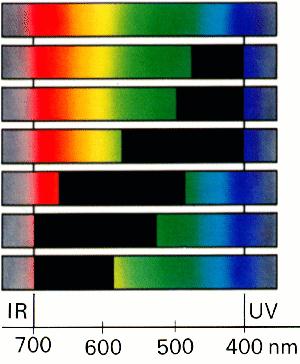
La lumière visible n'est qu'une partie du spectre électromagnétique. Cette lumière est composé de photons. L'énergie d'un photon est définie par sa longueur d'onde. Si le même nombre de photons de toutes les longueur d'ondes de la lumière visible arrive vers notre oeil, nous voyons de la lumière blanche. De même, un objet nous paraît blanc s'il renvoie vers notre oeil tous les photons dont la lumière blanche est composée, de façon régulière. Avec un prisme ou une "grille de diffraction" (constituée d'un grand nombre de lignes fines et parallèles, comme par exemple un CD), les différentes longueurs d'ondes peuvent être séparées. On peut alors visualiser un spectre composé de toutes les couleurs dont est composée la lumière blanche; ces couleurs sont rangées en fonction de leur énergie (voir figure 1). Si une partie de la lumière d'une certaine énergie est absorbée, alors nous percevons ce qui reste, c'est à dire les couleurs complémentaires de la lumière absorbée.
|
|
|
Question 1 |
Quelle couleur visible correspond à chacun des spectres ci-dessous ? N'oubliez pas qu'on voit la couleur complémentaire de celle absorbée. Une réponse vous est donnée pour vous aider! |
|
spectre |
couleur résultante | |
 |
 |
|
© 2004 Seesing, Tausch; Universität Duisburg-Essen, Duisburg [Lit:Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993]
|
|
 |
|
|
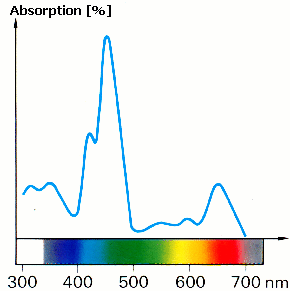
Dans la nature, beaucoup de choses sont colorées. La plupart absorbent dans plusieurs zones du spectre visible. Généralement l'absorption n'est pas égale dans toutes les parties (voir Fig.2). Ceci permet d'obtenir un spectre d'absorption caractéristique de chaque substance, qui peut ainsi servir à son identification. De plus, deux substances composées des mêmes espèces chimiques peuvent être plus ou moins claires: deux feuilles d'arbres, composées toutes deux de chlorophylle, peuvent avoir des verts différents.
|
|
Question 2 |
Essayez de deviner pourquoi deux échantillons de la même substance peuvent paraître plus ou moins clairs et justifiez votre réponse. Dessinez le spectre d'une chlorophylle b plus foncée sur la figure 2. |
|
 |
 |
 |
|
Figure 2: spectre d'absorption de la chlorophylle b
© Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993
|
|
|
Les bases de la spectrométrie
La spectroscopie permet d'identifier et de quantifier des substances. Au laboratoire, on peut examiner différentes substances avec un photomètre (aussi appelé spectromètre) de façon à pouvoir exploiter les résultats qu'on obtient avec un satellite qui observe l'atmosphère terrestre. (voir par exemple le spectre de l'atmosphère fait pas le satellite GOME sur les pages d'ESPERE: voir "Basse Atmosphère / Plus/ 1.Chimie atmosphérique".)
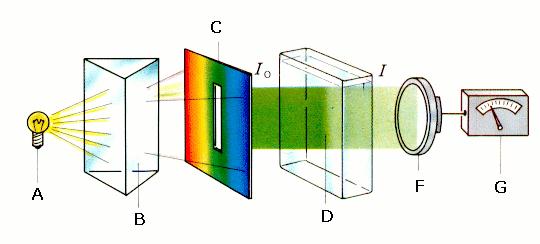
Un photomètre est constitué des éléments indiqués sur la Figure 3 : |
 |
 |
|
Figure 3:
Détails d'un photomètre A: source de lumière; B: monochromateur (prisme ou grille de diffraction); C: ouverture; D: cuve avec l'échantillon; F: photosenseur; G: amplificateur avec lecture montrant l'EXTINCTION; Io: intensité de la lumière devant l'échantillon I: intensité de la lumière derrière l'échantillon. La valeur de la mesure d'EXTINCTION donne la relation entre l'intensité de la lumière qui a traversé l'échantillon (I) et l'intensité de la lumière originale (Io).
© 2004 Seesing, Tausch; Universität Duisburg-Essen, Duisburg [Lit:Tausch, von Wachtendonk: Chemie SII, Buchner Verlag, Bamberg 1993]
|
Selon les appareils les valeurs mesurées sont données en pourcentages ou en logarithme.
|
 |
|
|
On peut changer de nombreux paramètres dans un photomètre. On peut choisir d'utiliser une lampe différente, par exemple avec les appareils qui fonctionnent dans la zone ultraviolette du spectre électromagnétique, on peut élargir ou diminuer l'ouverture, on peut changer la position du monochromateur, la température de l'échantillon, et l'amplification. On peut aussi faire varier l'épaisseur de l'échantillon en changeant la cuve.
|
Question 3 |
Qu'avez-vous à changer exactement et de manière continue pour obtenir la spectre de la Figure 2? Justifiez votre réponse. | |
|
Les savants Johann Heinrich Lambert (1728-1777) et August Beer (1825-1863) ont été à l'origine, grâce à leurs travaux, de nombreux théorèmes, dont la loi de Beer-Lambert :
|
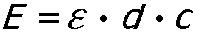 |
 |
|
E: extinction; epsilon coefficient d'extinction molaire (constante qui est fonction de la longueur d'onde et des caracteristiques de la substance absorbante); d: epaisseur de l'echantillon; c: concentration de la substance absorbante
|
|
Question 4 |
Vous avez fait des hypothèses pour répondre à la question 2. Repensez-y au regard de la loi de Beer-Lambert. Qu'est-ce qui est proportionnel à l'extinction et qui peut être vérifié expérimentalement? |
|
Question 5 |
Discutez vos résultats des questions 3 et 4 ! |
|
|
A propos de cette page:
auteur: M. Seesing, M. Tausch - Universität Duisburg-Essen, Duisburg / Germany
relecteur scientifique: Dr. Mark Lawrence, MPI for Chemistry, Mainz, 2004-05-05
dernière version: 2004-05-13 |
|
 |
|







