|
|
 |
|
|
|
 |
| |
|
|
 |
Basse atmosphère
Plus |
Les réactions dans l'atmosphère
De nombreux composés chimiques sont continuellement émis dans l'atmosphère, naturellement ou par les humains. Ces composés s'accumuleraient s'ils ne disparaissaient pas. Ils peuvent retomber sur le sol (c'est ce qu'on appelle le dépôt sec) ou être emmenés par les pluies (dépôt humide). En particulier, certains composés dans l'atmosphère disparaissent plus facilement une fois qu'ils ont subi des réactions chimiques qui leur permettent d'être "happés" par les gouttes d'eau.
|
|
|
|
|
 |
 |
 |
|
1. OH "nettoie" l'air
image: Elmar Uherek
|
|
 |
Les réactions qu'on appelle oxydations ne veulent pas dire nécessairement qu'elles ont lieu avec des composés contenant de l'oxygène. Cependant dans la plupart des cas, des atomes d'oxygène entre en jeu. Il y a trois oxydants majeurs dans l'atmosphère:
le radical hydroxyle OH
le radical nitrate NO3
la molécule d'ozone O3
Le plus important d'entre eux est le radical OH. Un radical est comme un "morceau" de molécule à qui il manquerait quelque chose, ce qui le rend apte à réagir avec beaucoup de composés, et très rapidement, parce qu'il cherche à s'accoler aux autres molécules de l'air. Le radical OH est très très réactif et est capable de réagir avec l'immense majorité des composés atmosphériques.
C'est pourquoi OH est appelé le 'détergent de l'atmosphère'.
|
Seules quelques rares composés ne réagissent pas -ou quasiment pas- avec OH. C'est le cas par exemple des tueurs d'ozone que sont les chlorofluorocarbones CFCs (par exemple CF2Cl2), mais aussi du protoxyde d'azote N2O et du dioxyde de carbone CO2 qui sont très stables. De même, la réaction avec le méthane CH4 est 100 ou 1000 fois plus lente qu'avec d'autres composés contenant du carbone. Ceci explique que les concentrations de méthane (environ 1.7 ppm = 1.7 µmol/mol) sont si élevées dans l'atmosphère, comparativement à certains composés de la même famille dont les concentrations sont 1000 fois moindres environ.
|
 |
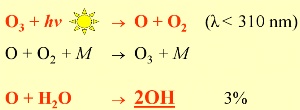 |
 |
|
2. Formation de OH: plus de 97% des atomes d'oxygène O, formés par la photolyse de l'ozone, réagissent pour redonner de nouveau de l'ozone. Moins de 3% par contre permettent de démarrer la formation du radical le plus important de l'atmosphère qu'est OH
Lorsque deux atomes ou deux molécules A et B se percutent pour former une molécule C, il faut souvent une molécule M, extérieure à la réaction, pour absorber l'excès d'énergie créé lors du choc. Cette molécule M (généralement du diazote N2) ne réagit pas et sert juste d'absorbeur d'énergie.
|
|
 |
 |
|
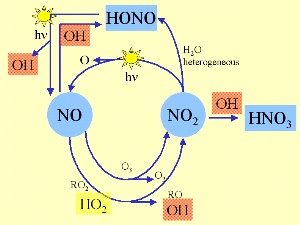
3. Le cycle de l'OH et des oxydes d'azote
Schéma par Elmar Uherek
Cliquez pour agrandir (90 K)
|
|
 |
Comment se forme OH ?
OH est le maître incontesté de la chimie diurne, sa formation dépendant au départ du rayonnement solaire. La réaction initiale est la cassure de l'ozone par les rayons du soleil (on appelle cela la photolyse) de longueurs d'ondes inférieures à 310 nm, suivie par la réaction de l'eau avec l'atome d'oxygène O issu de la molécule d'ozone cassée. C'est pourquoi il est nécessaire pour la formation d'OH d'avoir une certaine quantité d'ozone dans la troposphère, sachant que l'excès d'ozone n'est pas bon pour la santé.
D'autres réactions fabriquent OH : les photolyses de l'acide nitreux HONO, la réaction de NO avec HO2 ou les réactions des alcènes avec l'ozone. Le schéma ci-contre détaille les cycles réactifs de OH et des oxydes d'azote.
|
Combien d'OH se forme-t-il ?
Le radical OH étant très réactif, il réagit en fait dès qu'il se forme. Sa durée de vie est inférieure à 1 seconde. Cela signifie que sa concentration est très faible, de l'ordre de 1x105 à 2x107 molécules cm-3.
Sa formation dépendant de la quantité de vapeur d'eau dans l'air, la concentration de OH a tendance à diminuer avec l'altitude (l'air y est plus froid et plus sec).
|
 |
 |
 |
|
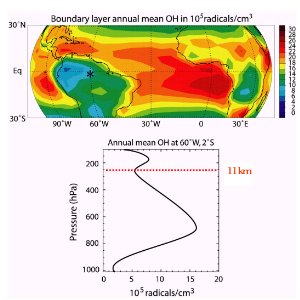
4. la répartition de OH, à gauche lors de l'hiver dans l'hémisphère Nord, à droite lors de l'été dans ce même hémisphère.
C'est à environ 11 km d'altitude qu'on trouve une pression de 250 hPa (hauteur de la tropopause aux latitudes moyennes). Quelles sont les altitudes auxquelles on trouve des pressions de 1000, 800, 600 et 400 hPa? Utilisez le diagramme pression - altitude !
source: presentation J. Lelieveld - MPI Mainz 2003
Cliquez pour agrandir (80 K)
|
|
Mais sa concentration diminue aussi en allant vers les pôles, non seulement parce que la concentration de la vapeur d'eau diminue, mais aussi parce que l'ensoleillement diminue en durée et en intensité lorqu'on monte vers les pôles.
Comment OH réagit-il ?
L'image ci-contre à droite montre ce qui se passe dans les forêts pluviales tropicales. La concentration de OH diminue au niveau du sol. Pourquoi? En fait, les arbres émettent de nombreux composés (dont l'isoprène) qui réagissent avec OH et le font donc disparaître. Il est consommé par les réactions chimiques. OH a une forte tendance a arracher les atomes d'hydrogène des composés organiques (= composés contenant du carbone, ceux fabriqués par les arbres), et à former ainsi de l'eau H2O. A l'étape suivante, le composé à qui il manque son atome d'hydrogène va réagir avec l'oxygène O2 pour former des composés, qui sont essentiels par exemple dans le cycle de formation de l'ozone.
|
 |
 |
 |
|
5. la répartition d'OH dans les tropiques
en haut: répartition dans les régions tropicales
en bas: concentration en fonction de l'altitude au dessus de la forêt pluviale de Manaus (Brésil)
source: présentation J. Lelieveld MPI Mainz 2003
Cliquez pour agrandir (80 K)
|
|
|
Cependant, à l'échelle mondiale ce n'est pas avec les composés organiques émis par les forêts que OH réagit le plus. Les composés organique sont responsables de 30% de la consommation de OH, plus 15% pour le méthane (qui est la molécule organique la plus petite et la plus importante). Les principaux gaz qui réagissent avec OH sont le monoxyde de carbone (40%) puis l'ozone, le radical péroxyde HO2 et l'hydrogène H2.
|
 |
 |
|
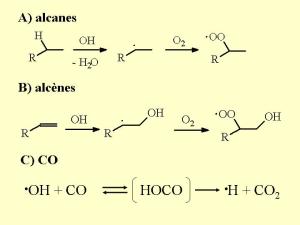
6. Les réactions importantes de OH dans la troposphère
Cliquez pour agrandir! (20 K)
|
|
 |
OH peut aussi transformer le monoxyde de carbone CO en dioxyde de carbone CO2. Cette réaction et celle de OH avec le méthane sont très importantes car ce sont les plus consommatrices de OH et tendent donc à faire diminuer sa quantité dans l'atmosphère. Les autres composés organiques très réactifs sont en très faibles quantités dans l'atmosphère, tandis que les concentrations de CO atteignent 120 ppb (soit 12 10-6 %) dans l'hémisphère nord et 60 ppb dans l'hémisphère sud (où il y a moins de combustions).
|
OH est donc le composé le plus important pour la multitude de réactions chimiques atmosphériques. Cependant, la nuit sa concentration est proche de zéro puisque le rayonnement solaire est la condition sine qua non de sa formation. C'est pourquoi, pendant la nuit ou le crépuscule, d'autres composés jouent son rôle, comme le nitrate NO3 et l'ozone O3.
|
 |
 |
 |
|
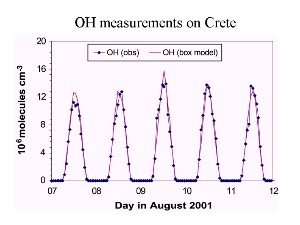
7. Evolution des concentrations de OH sur plusieurs jours, d'après des mesures en août 2001 en Crète ("obs") et des estimations simulées ("box model"). On voit que les concentrations sont maximales le jour et reviennent à zéro chaque nuit.
Source: Présentation J. Lelieveld MPI Mainz 2003
|
|
Le rapport de mélange est souvent exprimé en ppm ou en ppb (1 ppm = 1 molécule parmi 1 million de molécules, 1 ppb = 1 molécule parmi 1 milliard de molécules); cette unité a la même signification que les pourcentages, "en beaucoup plus petit". Cependant, on pourrait aussi utiliser l'unité 1 µmol/mol (= 1 ppm) ou 1 nmol/mol (= 1 ppb). Ceci car la quantité de molécules n est mesurée dans l'unité mol.
|
A propos de cette page:
auteur: Dr. Elmar Uherek - MPI for Chemistry Mainz
relecteur scientifique: Dr. Mark Lawrence, MPI for Chemistry, Mainz, 2004-05-05
relecteur pédagogique: Michael Seesing - Uni Duisburg - 2003-07-02
dernière version: 2004-05-07 |
|
 |
|







